Výskyt myokarditídy a perikarditídy u neočkovaných pacientov po COVID-19
- veľká populačná štúdia
Abstrakt
Myokarditída a perikarditída sú potenciálne postakútne kardiálne následky infekcie COVID-19, ktoré vznikajú v dôsledku adaptívnych imunitných reakcií. Naším cieľom bolo preskúmať výskyt postakútnej myokarditídy a perikarditídy spôsobenej COVID-19. Retrospektívna kohortová štúdia 196 992 dospelých po infekcii COVID-19 u členov spoločnosti Clalit Health Services v Izraeli v období od marca 2020 do januára 2021. Diagnózy hospitalizovanej myokarditídy a perikarditídy boli získané od 10. dňa po pozitívnej PCR. Sledovanie bolo cenzurované 28. februára 2021 s minimálnou dobou sledovania 18 dní. Kontrolná kohorta 590 976 dospelých s aspoň jednou negatívnou PCR a žiadnou pozitívnou PCR zodpovedala veku a pohlaviu. Keďže izraelský očkovací program sa začal 20. decembra 2020, časová zhoda kontrolnej kohorty sa vypočítala spätne od 15. decembra 2020. U deviatich pacientov po očkovaní vakcínou COVID-19 sa vyvinula myokarditída (0,0046 %) a u jedenástich pacientov bola diagnostikovaná perikarditída (0,0056 %). V kontrolnej skupine malo 27 pacientov myokarditídu (0,0046 %) a 52 pacientov malo perikarditídu (0,0088 %). Vek (upravený pomer rizika [aHR] 0,96, 95 % interval spoľahlivosti [CI]; 0,93 až 1,00) a mužské pohlavie (aHR 4,42; 95 % CI, 1,64 až 11,96) boli spojené s myokarditídou. Mužské pohlavie (aHR 1,93; 95 % CI 1,09 až 3,41) a periférne cievne ochorenie (aHR 4,20; 95 % CI 1,50 až 11,72) boli spojené s perikarditídou. Infekcia po COVID-19 nebola spojená ani s myokarditídou (aHR 1,08; 95 % CI 0,45 až 2,56), ani s perikarditídou (aHR 0,53; 95 % CI 0,25 až 1,13). U dospelých pacientov zotavujúcich sa z infekcie COVID-19 sme nepozorovali zvýšený výskyt perikarditídy ani myokarditídy.
1. Úvod
Koronavírusové ochorenie 2019 (COVID-19) spôsobené koronavírusom ťažkého akútneho respiračného syndrómu 2 (SARS-CoV-2) je hlavnou príčinou morbidity a mortality na celom svete [1]. Okrem klinických prejavov počas akútnej fázy ochorenia COVID-19 sa hromadia údaje týkajúce sa subakútnych a dlhodobých účinkov COVID-19, známych aj ako "postakútny syndróm COVID-19" alebo "dlhý COVID", definovaný pretrvávajúcimi príznakmi niekoľko týždňov po začiatku infekcie COVID-19 [2]. "Dlhý COVID" alebo "postakútny syndróm COVID-19" je charakterizovaný multiorgánovými následkami alebo pretrvávajúcimi príznakmi po zotavení sa z akútnej fázy COVID-19, vo všeobecnosti po 3 až 4 týždňoch od začiatku príznakov alebo prvého pozitívneho výsledku PCR testu [3].
Patogenéza "Long-COVID" môže byť výsledkom viacerých mechanizmov vrátane priamej vírusovej toxicity, hyperkoagulácie, mikrovaskulárneho poškodenia a maladaptácie angiotenzín konvertujúceho enzýmu [4]. Hoci základné patofyziologické mechanizmy vedúce k postakútnemu COVID-19 ešte nie sú úplne objasnené, predpokladá sa, že imunitná odpoveď [5,6] a imunitná dysregulácia [4] zohrávajú v patogenéze tohto syndrómu významnú úlohu. Neexistuje zhoda v tom, ktorý časový bod predstavuje prechod z akútnej infekcie COVID-10 a fázu zotavenia. Keďže sme uvažovali o nepriamom imunitne sprostredkovanom zápale ako o potenciálnom mechanizme vysvetľujúcom oneskorenú peri/myokarditídu, usúdili sme, že 10 dní po infekcii je relevantný časový bod, pretože to platí v súvislosti s perikarditídou po infarkte myokardu (Dresslerov syndróm) alebo kardiochirurgickom zákroku (postperikardiotomický syndróm).
Ukázalo sa, že infekčné príčiny sú dôležitou podnetnou udalosťou v patofyziológii autoimunitných ochorení [7]. Vírusové infekcie sa tiež spájajú s prítomnosťou autoimunitných ochorení, ako je systémové ochorenie lupus, reumatoidná artritída a diabetes mellitus [8].
Pri vírusových infekciách sa do patogenézy následnej myokarditídy zapojili tak priame kontaktné, ako aj replikáciou vyvolané poškodenie a autoimunitné mechanizmy. Nevhodná regulácia T-buniek vyplývajúca zo zmenených autoproteínov súvisiacich s patogénom alebo z molekulárnej mimikry medzi vírusom a hostiteľom alebo nadmerná aktivácia B-buniek môže viesť k neprimeranému imunitne sprostredkovanému poškodeniu hostiteľského tkaniva [9]. Táto oneskorená neprimeraná odpoveď ako taká môže vyvolať autoimunitné ochorenia, ako je myokarditída a perikarditída [10]. V súlade s tým sa u podskupiny pacientov s idiopatickou dilatačnou kardiomyopatiou v niektorých prípadoch považuje za príčinu predchádzajúca myokarditída a príkladom podporujúcim asociatívnu etiopatogenézu je výskyt protilátok proti adrenoreceptorom beta 1 [11].
S predchádzajúcou infekciou COVID-19 sa spájalo niekoľko autoimunitných javov vrátane heparínom indukovanej trombocytopénie (HITT), Kawasakiho syndrómov (MIS-C a MIS-A), Guillainovho-Barrého syndrómu, vaskulitídy a tyroiditídy [8]. Možno teda postulovať, že riziko autoimunitne indukovanej myokarditídy a perikarditídy je u zotavujúcich sa pacientov s COVID-19 zvýšené.
Nedávno sa zistilo, že výskyt myokarditídy a perikarditídy je u pacientov s COVID-19 zvýšený počas akútneho ochorenia [12]. Avšak; či myokarditída a perikarditída po období zotavovania sú alebo nie sú súčasťou dlhodobého syndrómu COVID-19, zatiaľ nie je známe. V tejto práci sme skúmali výskyt myokarditídy a perikarditídy vo veľkej skupine pacientov s COVID-19 po zotavení z akútnej infekcie.
2. Metódy
2.1. Súbor štúdií
Získali sme údaje z pozorovania zo zdravotníckych služieb Clalit (CHS). CHS je najväčšia zo štyroch organizácií na udržiavanie zdravia, ktoré ponúkajú povinné zdravotné poistenie v Izraeli. CHS poisťuje viac ako 50 % izraelskej populácie (> 4,4 milióna osôb) a populácia poistená v CHS je približne reprezentatívna pre celú izraelskú populáciu [12,13]. CHS poskytuje ambulantnú starostlivosť a lôžková starostlivosť je rozdelená medzi CHS a iné nemocnice. Výskumné údaje možno získať z centrálneho dátového skladu pomocou platformy CHS Secure Data Sharing Platform powered by MDClone (https://www.mdclone.com, prístup 5. septembra 2021).
Táto štúdia bola schválená inštitucionálnou revíznou komisiou a bola oslobodená od požiadavky informovaného súhlasu.
2.2. Návrh štúdie a populácia pacientov
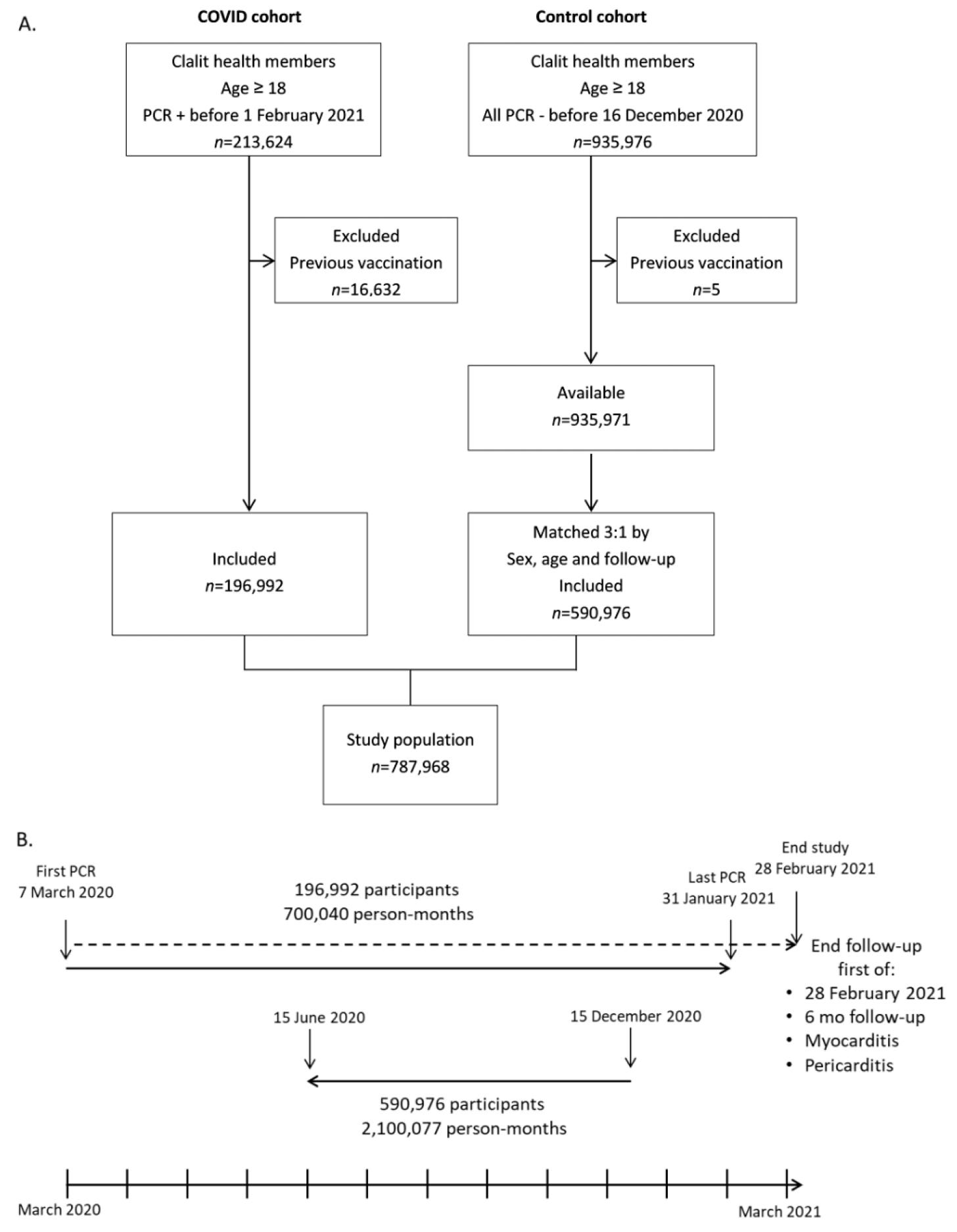
Získali sme záznamy všetkých dospelých pacientov (vo veku ≥ 18 rokov), ktorí mali zdokumentovaný pozitívny test COVID-19 PCR (n = 213 624) v období od 7. marca 2020 do 31. januára 2021 (obrázok 1A). Záznamy obsahovali demografické údaje a kardiovaskulárne rizikové faktory: fajčiarsky status, obezita, diabetes mellitus, hyperlipidémia, CKD (chronické ochorenie obličiek), PVD (periférne cievne ochorenie, ACS (akútny koronárny syndróm), esenciálna hypertenzia, CVA (cerebrovaskulárna nehoda) a srdcové zlyhanie (zoznam kódov Medzinárodnej klasifikácie chorôb (ICD-10) pre všetky diagnózy nájdete v tabuľke S1). Diagnostické hospitalizačné kódy pre myokarditídu (I40, I40.9, I51.4) a perikarditídu (I30, I30.0, I30.9) boli extrahované v období od 10 dní po infekcii COVID-19 a najskôr v období od 6 mesiacov od infekcie alebo od 28. februára 2021. Týmto spôsobom sa zabezpečilo minimálne obdobie sledovania 18 dní a maximálne obdobie sledovania 6 mesiacov. Keďže údaje sa získavali počas októbra 2021, umožnili sme viac ako 6-mesačné oneskorenie prenosu údajov medzi nemocnicami, ktoré nepatria do CHS, a dátovým skladom CHS. Časový rámec po COVID bol definovaný od najmenej desiatich dní od dátumu pozitívneho PCR testu podmieneného absenciou príznakov súvisiacich s infekciou COVID-19 podľa definícií izraelského ministerstva zdravotníctva. Pacienti s prvým očkovaním absolvovaným pred infekciou COVID-19 boli vylúčení (n = 16 632), čím vznikla konečná kohorta COVID-19 (n = 196 992).
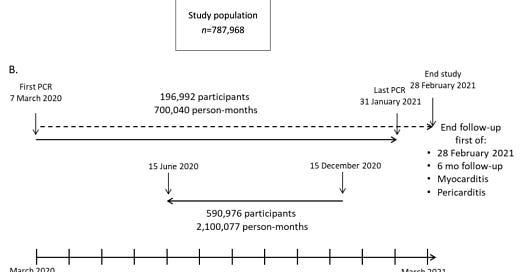
Obrázok 1. Profil štúdie, dizajn a časový harmonogram. 'Clalit' = Clalit Health Services. Očkovanie = očkovanie vakcínou COVID-19. PCR -/+ = negatívna/pozitívna PCR COVID-19. (A). Vývojový diagram výberu pacientov v kohortách COVID a kontrolných kohortách. (B). Časová os výskumu od prvej PCR 7. marca 2020 do ukončenia štúdie (spodná časť). Kohorta COVID je znázornená v hornej časti a zodpovedajúce obdobie kontrolnej kohorty je znázornené v strede.
Kontrolná skupina bola vytvorená z kohorty dospelých pacientov s aspoň jedným negatívnym PCR COVID-19 v období od 7. marca 2020 do 15. decembra 2020 a bez predchádzajúceho pozitívneho PCR COVID-19 pred získaním údajov v auguste 2021 (n = 935 976). Ako dátum ukončenia bol zvolený 15. december 2020, keďže masívna izraelská očkovacia kampaň sa začala 20. decembra 2020. Napriek tomu bolo päť pacientov vylúčených z dôvodu predchádzajúceho očkovania proti COVID-19. Z tohto súboru pacientov (n = 935 971) bola vytvorená kontrolná kohorta na základe porovnania veku (±2 roky) a pohlavia v pomere 3:1 (n = 590 976). Obdobie sledovania každého z troch kontrolných pacientov bolo nastavené na presne rovnakú dĺžku sledovania zodpovedajúceho pacienta s COVID-19. Obdobie sledovania sa vypočítalo spätne od 15. decembra 2020 (obrázok 1B), aby sa zabránilo potenciálnemu vplyvu očkovania proti COVID-19 na myokarditídu a perikarditídu. Hoci obdobie vypracovania projektu pacientov COVID-19 bolo od marca 2020 do januára 2021, takmer všetky prípady COVID-19 sa vyskytli medzi júlom 2020 a januárom 2021 (obrázok S1).
2.3. Štatistická analýza
Základné charakteristiky kohort sme porovnali pomocou chí-kvadrát testu. Na posúdenie vplyvu infekcie po COVID-19 na myokarditídu a perikarditídu sme použili Kaplanove-Meierove krivky kumulatívnej incidencie až do maximálneho sledovania šesť mesiacov. Použili sa univariabilné a multivariabilné Coxove regresné modely proporcionálnych rizík. Do upravených modelov boli zavedené faktory ako infekcia po COVID, vek, pohlavie, BMI, diabetes, hyperlipidémia, obezita, chronické poškodenie obličiek, fajčiarsky status, periférne cievne ochorenie, akútny koronárny syndróm a esenciálna hypertenzia. Hrubý pomer rizika (HR) aj upravený HR (aHR) sú uvedené s 95 % intervalmi spoľahlivosti. Hodnota p menšia ako 0,05 sa považovala za štatisticky významnú. Štatistické analýzy sa vykonali pomocou programu R verzia 4.0.2, balíky: survival, Survminer, ggplot2 a pomocou programu SPSS verzia 26 (IBM).
3. Výsledky
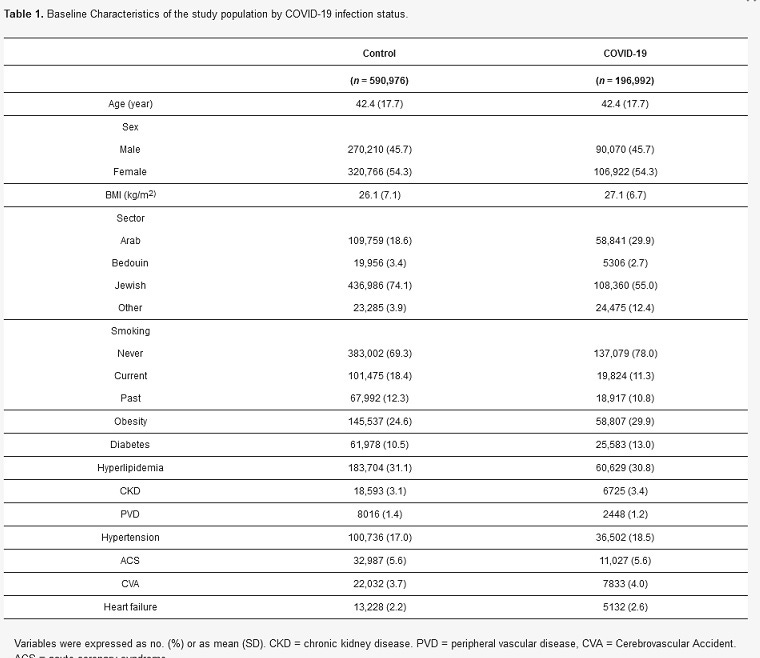
Do štúdie bolo zahrnutých 787 968 dospelých členov spoločnosti Clalit Health Services (vek ≥ 18 rokov) (obrázok 1), ktorí pozostávali z kohorty COVID-19 (n = 196 992) a pohlavne a vekovo zodpovedajúcej kontrolnej kohorty 3:1 (n = 590 976). Celkový počet sledovaných osôb bol 700 040 osobomesiacov v kohorte COVID-19 a 2 100 077 osobomesiacov v kontrolnej kohorte s mediánom sledovania 4,1 mesiaca [IQR 1,3 - 5,6 mesiaca]. Priemerná štandardná odchýlka (SD) veku v oboch skupinách bola 42,4 (17,7) roka a 45,7 % tvorili muži (tabuľka 1). V skupine COVID-19 bol mierne vyšší BMI (priemer (SD) 27,1 (7,1) vs. 26,1 (6,7) kg/m2) s vyšším výskytom obezity (29,9 % vs. 24,6 %), diabetes mellitus (13 % vs. 10,5 %), esenciálnej hypertenzie (18,5 % vs. 17 %), cerebrovaskulárnych príhod (4 % vs. 3,7 %) a srdcového zlyhania (2,6 % vs. 2,2 %). V kohorte COVID-19 bol nižší výskyt súčasného a minulého fajčenia (11,3 % oproti 18,4 % a 10,8 % oproti 12,3 %) a periférnych cievnych ochorení (1,2 % oproti 1,4 %).
Tabuľka 1. Základné charakteristiky skúmanej populácie podľa stavu infekcie COVID-19.
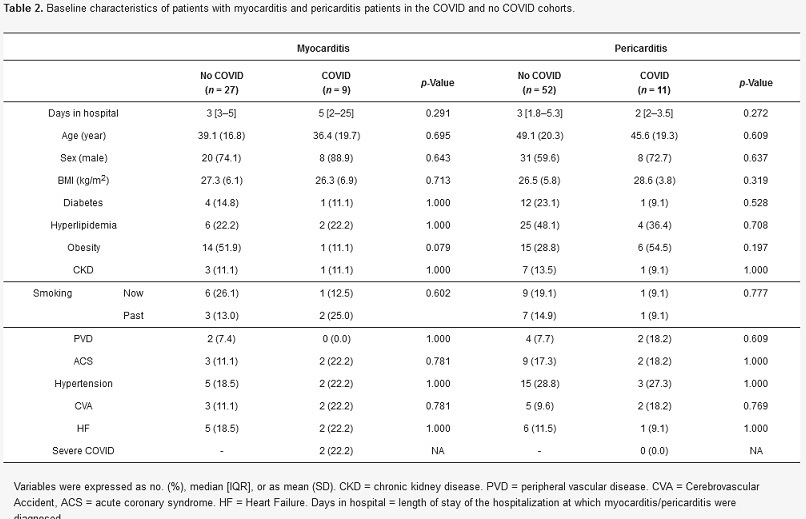
Počas obdobia štúdie sa v kohorte COVID-19 zistilo 9 prípadov myokarditídy a 11 prípadov perikarditídy (tabuľka 2). V kontrolnej kohorte bolo zistených 27 prípadov myokarditídy a 52 prípadov perikarditídy. Dvaja z deviatich pacientov s myokarditídou boli hospitalizovaní z dôvodu závažnej infekcie COVID-19 s potrebou mechanickej ventilácie a myokarditída bola diagnostikovaná počas hospitalizácie COVID-19 na 19. a 37. deň po infekcii. Žiadny z pacientov, u ktorých bola diagnostikovaná perikarditída, nebol hospitalizovaný kvôli infekcii COVID-19. Medián (IQR) trvania hospitalizácie po myokarditíde v kohorte COVID-19 bol 5 (2 - 25) dní oproti 3 (3 - 5) dňom v kontrolnej kohorte (p = 0,291). Medián (IQR) trvania hospitalizácie po perikarditíde bol 2 (2-3,5) dni v kohorte COVID-19 a 3 (1,8-5,3) dni v kontrolnej kohorte (p = 0,272).
Tabuľka 2. Základné charakteristiky pacientov s myokarditídou a pacientov s perikarditídou v kohortách COVID a bez COVID.
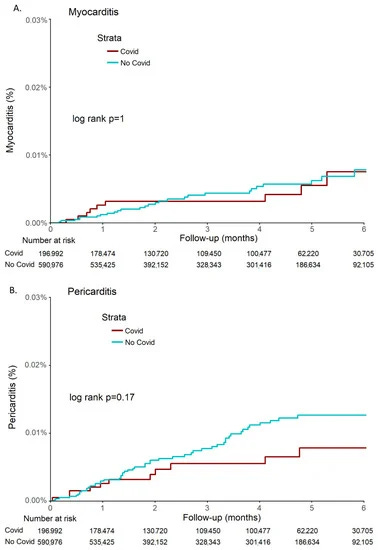
Medzi kohortou pacientov s COVID-19 a kontrolnou kohortou sa nepozoroval žiadny štatistický rozdiel v miere výskytu myokarditídy (p = 1) ani perikarditídy (p = 0,17) (obrázok 2).
Obrázok 2. Kaplanove-Meierove odhady kumulatívnej pravdepodobnosti výskytu myokarditídy (A) a perikarditídy (B) v kohortách COVID-19 a kontrolnej skupine počas 6 mesiacov.
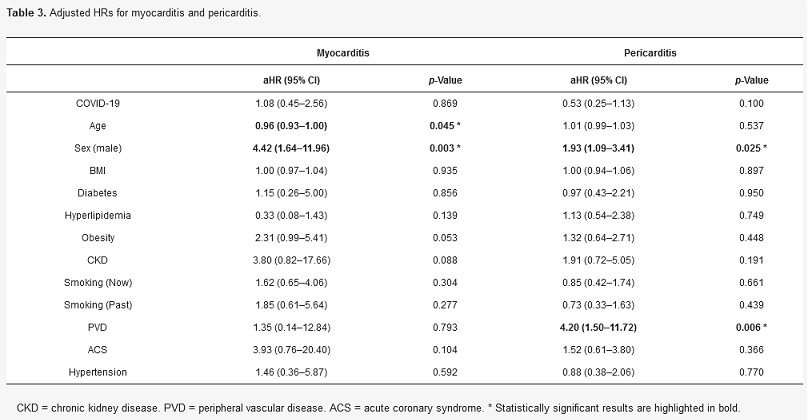
V multivariabilnom Coxovom regresnom modeli proporcionálnych rizík (tabuľka 3, tabuľky S2 a S3) boli vek (aHR 0,96; 95 % CI 0,93 až 1,00, p = 0,045) a mužské pohlavie (aHR 4,42; 95 % CI 1,64 až 11,96, p = 0,003) nezávisle spojené s myokarditídou. Obezita bola hranične spojená s myokarditídou (aHR 2,31; 95 % CI 0,99 až 5,41, p = 0,053). Infekcia po COVID-19 nebola spojená s myokarditídou (aHR 1,08; 95 % CI 0,45 až 2,56, p = 0,869).
Tabuľka 3. Upravené HR pre myokarditídu a perikarditídu.
Mužské pohlavie (aHR 1,93; 95 % CI 1,09 až 3,41, p = 0,025) a periférne cievne ochorenie (aHR 4,20; 95 % CI 1,50 až 11,72, p = 0,006) boli spojené s perikarditídou (tabuľka 3). Infekcia po COVID-19 nebola spojená s perikarditídou (aHR 0,53; 95 % CI 0,25 až 1,13, p = 0,1).
4. Diskusia
V súčasnej rozsiahlej populačnej štúdii osôb, ktoré neboli očkované proti SARS-CoV-2, sme od 10. dňa po pozitívnom náleze SARS-CoV-2 nepozorovali zvýšenie výskytu myokarditídy alebo perikarditídy. Multivariabilná analýza však ukázala, že mužské pohlavie je spojené s vyšším rizikom vzniku myokarditídy alebo perikarditídy bez ohľadu na predchádzajúcu infekciu COVID-19.
Infekcia COVID-19 je zodpovedná za značnú morbiditu a mortalitu v bezprecedentnom rozsahu na celom svete. Vyvíjajú sa kumulatívne vedecké a klinické údaje o subakútnych a dlhodobých účinkoch infekcie COVID-19, ktoré môžu postihnúť viaceré orgánové systémy. Nedávne štúdie naznačujú niekoľko mechanizmov patogenézy pretrvávajúcich a dlhotrvajúcich príznakov a symptómov spojených s kardiovaskulárnym systémom. Niekoľko skorších štúdií o infekciách SARS-CoV poukázalo na možnú súvislosť medzi typmi koronavírusových infekcií a imunitne sprostredkovanými reakciami [14,15].
Protilátky proti koronavírusu-OC43 a 229E sa našli u pacientov s diagnózou sklerózy multiplex [16]. U myší infikovaných koronavírusom myšej hepatitídy sa zistili vysoké a trvalé hladiny autoprotilátok proti erytrocytom [17].
Vzhľadom na klinickú podobnosť medzi SARS-CoV-2 a inými koronavírusmi [18,19] je možné predpokladať, že infekcia SARS-CoV-2 potenciálne vyvoláva aj imunitne sprostredkované poškodenie tkaniva. Molekulárne mimikry, aktivácia špecifických T-buniek na vírusom zmenené autoproteíny a aktivácia B-buniek predstavujú niekoľko príkladov mechanizmov sprostredkujúcich potenciálny výskyt myokarditídy a perikarditídy, ktoré by mohli zohrávať úlohu pri spustení oneskoreného zápalu srdca [9]. Okrem toho sa v nedávnej štúdii 309 pacientov s COVID-19 testovalo na prítomnosť šiestich rôznych autoprotilátok, ako sú antinukleárne protilátky a protilátky proti interferónu-α2, najmenej dva mesiace po počiatočnom ochorení. V tejto štúdii boli autoprotilátky spojené s vyšším rizikom vzniku postakútnych následkov COVID-19 [20].
Na začiatku pandémie COVID-19 bolo zrejmé, že pacienti s COVID-19 s kardiovaskulárnymi komorbiditami majú horšiu prognózu a vyššiu nemocničnú úmrtnosť [21]. Zdá sa, že osoby so základnými autoimunitnými ochoreniami sú obzvlášť zraniteľné voči závažným následkom vyplývajúcim z infekcie COVID-19 [22]. Iné štúdie preukázali, že závažné ochorenie COVID-19 sa spája so silnými zápalovými reakciami vrátane reakcií precitlivenosti druhého a štvrtého typu, ktoré sú výsledkom nadmernej aktivácie T-buniek a následnej cytokínovej búrky [23,24]. Imunitne sprostredkované prejavy COVID-19 zahŕňajú imitáciu autoimunitných ochorení, ako je Kawasakiho choroba, Guillainov-Barrého syndróm, vaskulitída, myozitída a poškodenie myokardu [25].
Puntmann a kol. zistili 78 % postihnutie srdca hodnotené pomocou magnetickej rezonancie srdca (MRI) u pacientov s potvrdenou diagnózou COVID-19 osem týždňov pred zaradením do štúdie [26], z ktorých väčšina bola asymptomatická alebo mala len mierne príznaky. Táto štúdia dokazuje zápal srdca nezávislý od závažnosti počiatočného ochorenia ani od celkového priebehu akútneho ochorenia. Nedávna štúdia preukázala zvýšené riziko neskorých kardiovaskulárnych následkov pri symptomatickej alebo asymptomatickej infekcii SARS-CoV-2 [27]. Preto sme sa snažili preskúmať aj to, či môže dôjsť k poškodeniu srdca aj bez ohľadu na prítomnosť symptómov súvisiacich s koronárnym ochorením. Ďalším potvrdením možného neskorého zápalového postihnutia perikardu a myokardu je ďalšia štúdia riadená kardiovaskulárnou magnetickou rezonanciou (CMR), ktorá preukázala edém myokardu, fibrózu a zhoršenú funkciu pravej komory u 58 % (16 z 25) pacientov, ktorí sa nedávno zotavili z COVID-19 [28]. Tieto štúdie podporuje aj pitevná štúdia poukazujúca na výskyt mononukleárnych infiltrátov u pacientov s infekciou COVID-19 [29]. Dôležitou výhradou týchto štúdií je však nedostatok vhodných kontrol vrátane pacientov s inými interkurentnými vírusovými infekciami.
Podobne ako v našej štúdii Xie a kol. preukázali, že u jedincov s infekciou COVID-19 je zvýšené riziko kardiovaskulárnych komplikácií 30 dní po infekcii vrátane perikarditídy a myokarditídy bez ohľadu na potrebu hospitalizácie [30]. V porovnaní s našou štúdiou bola skúmaná populácia testovaná na riziko zápalových ochorení srdca bez ohľadu na predchádzajúce očkovanie proti SRAS-COV-2. Napriek tomu v štúdii Xie et al. bola testovaná kohorta homogénna, pozostávajúca z príslušníkov amerického ministerstva pre záležitosti veteránov s prevahou mužov a mladého veku. Rozdiel v charakteristikách populácie môže vysvetľovať rozdielnosť výsledkov štúdií, keďže je známe, že mladí muži vykazujú vyšší výskyt myokarditídy a perikarditídy.
Vyššie riziko myokarditídy (pomer rizika 18,28; 95 % CI, 3,95 až 25,12; rozdiel rizika 11,0 príhod na 100 000 osôb; 95 % CI, 5,6 až 15,8) a perikarditídy sa pozorovalo vo veľkej populačnej štúdii nedávno publikovanej Bardom a kol [12]. Hoci naša štúdia aj štúdia Barda et al. vychádzajú z pacientov Clalit Health Service, medzi štúdiami je niekoľko dôležitých rozdielov. Barda et al. sa zamerali na očkovanie proti COVID-19, a preto bolo porovnanie navrhnuté tak, aby neutralizovalo faktory súvisiace s očkovaním, zatiaľ čo naša štúdia je na neočkovanej populácii. Barda et al. skúmali výskyt myokarditídy a perikarditídy od pozitívnych výsledkov PCR do 42 dní, zatiaľ čo my skúmame zotavujúcich sa pacientov od 10 dní po infekcii a podstatne dlhší čas. Analýza Barda et al. tiež ignoruje načasovanie vzniku myokarditídy a perikarditídy. Napokon, zatiaľ čo Barda et al. zahrnuli mnoho príčin myokarditídy a perikarditídy, my sme zahrnuli len akútnu myokarditídu a perikarditídu u hospitalizovaných pacientov, čo je pravdepodobnejšie.
Naša súčasná štúdia má niekoľko obmedzení. Po prvé, hoci potenciálny počet účastníkov, ktorí prichádzali do úvahy na zaradenie, bol veľký, počet prípadov myokarditídy a perikarditídy bol malý. Bolo to spôsobené najmä obmedzením relatívne krátkeho obdobia sledovania v dôsledku začatia masívneho očkovacieho programu. Po druhé, do štúdie sme zaradili len prípady hospitalizovaných pacientov s myokarditídou alebo perikarditídou, zatiaľ čo ambulantné zdravotné záznamy boli zo štúdie vylúčené. To mohlo pravdepodobne vynechať malý počet pacientov s miernym ochorením. Okrem toho sme zahrnuli diagnózu myokarditídy a perikarditídy podľa lekárskych záznamov bez prístupu k informáciám o potvrdení diagnózy na základe údajov od pacienta.
5. Závery
Naše údaje naznačujú, že u pacientov vyliečených z COVID-19 nedochádza k zvýšenému výskytu myokarditídy a perikarditídy v porovnaní s neinfikovanými zodpovedajúcimi kontrolami. Na odhad výskytu perikarditídy a myokarditídy u pacientov s diagnózou COVID-19 budú potrebné ďalšie dlhodobejšie štúdie.
Doplňujúce materiály
Nasledujúce podporné informácie si môžete stiahnuť na adrese: https://www.mdpi.com/article/10.3390/jcm11082219/s1, obrázok S1. Počet pacientov s pozitívnou PCR v kohorte COVID-19 podľa mesiacov počas obdobia štúdie. Tabuľka S1. Kódy ICD-10 pre kardiálne rizikové faktory. Tabuľka S2. Hrubé a upravené HR pre myokarditídu. Tabuľka S3. Hrubé a upravené HR pre perikarditídu.
preklad: Kishimo Katana
Ortal Tuvali,1,† Sagi Tshori2,† Estela Derazne 3, Rebecca Regina Hannuna 2, Arnon Afek 3,4, Dan Haberman 1, Gal Sella 1 a Jacob George 1
1 Heart Center, Kaplan Medical Center, Rehovot, Hebrew University of Jerusalem, Jerusalem 91905, Israel
2 Research Authority, Rehovot, Hebrew University of Jerusalem, Jerusalem 91905, Israel
3 Sackler Faculty of Medicine, Tel Aviv University, Tel Aviv 6997801, Israel
4 General Management, The Chaim Sheba Medical Centre, Tel Hashomer, Ramat-Gan 52621, Israel
† These authors contributed equally to this work.
Academic Editor: Andrea Frustaci
J. Clin. Med. 2022, 11(8), 2219; https://doi.org/10.3390/jcm11082219
Received: 25 March 2022 / Revised: 11 April 2022 / Accepted: 12 April 2022 / Published: 15 April 2022
(This article belongs to the Section Cardiology)
link - https://www.mdpi.com/2077-0383/11/8/2219/htm
supplement - https://www.mdpi.com/article/10.3390/jcm11082219/s1
References
1. Paules, C.I.; Marston, H.D.; Fauci, A.S. Coronavirus Infections—More Than Just the Common Cold. JAMA 2020, 323, 707–708. [Google Scholar] [CrossRef] [PubMed]
2. Lopez-Leon, S.; Wegman-Ostrosky, T.; Perelman, C.; Sepulveda, R.; Rebolledo, P.A.; Cuapio, A.; Villapol, S. More than 50 long-term effects of COVID-19: A systematic review and meta-analysis. Sci. Rep. 2021, 11, 16144. [Google Scholar] [CrossRef] [PubMed]
3. Raveendran, A.V.; Jayadevan, R.; Sashidharan, S. Long COVID: An overview. Diabetes Metab. Syndr. Clin. Res. Rev. 2021, 15, 869–875. [Google Scholar] [CrossRef] [PubMed]
4. Shuwa, H.A.; Shaw, T.N.; Knight, S.B.; Wemyss, K.; McClure, F.A.; Pearmain, L.; Prise, I.; Jagger, C.; Morgan, D.J.; Khan, S.; et al. Alterations in T and B cell function persist in convalescent COVID-19 patients. Med 2021, 2, 720–735.e4. [Google Scholar] [CrossRef] [PubMed]
5. McElvaney, O.J.; McEvoy, N.L.; McElvaney, O.F.; Carroll, T.P.; Murphy, M.P.; Dunlea, D.M.; Ni Choileain, O.; Clarke, J.; O’Connor, E.; Hogan, G.; et al. Characterization of the Inflammatory Response to Severe COVID-19 Illness. Am. J. Respir. Crit. Care Med. 2020, 202, 812–821. [Google Scholar] [CrossRef]
6. Tang, N.; Li, D.; Wang, X.; Sun, Z. Abnormal Coagulation parameters are associated with poor prognosis in patients with novel coronavirus pneumonia. J. Thromb. Haemost. 2020, 18, 844–847. [Google Scholar] [CrossRef]
7. Ercolini, A.M.; Miller, S.D. The role of infections in autoimmune disease. Clin. Exp. Immunol. 2009, 155, 1–15. [Google Scholar] [CrossRef]
8. Yazdanpanah, N.; Rezaei, N. Autoimmune complications of COVID-19. J. Med. Virol. 2021, 94, 54–62. [Google Scholar] [CrossRef]
9. Fujinami, R.S.; von Herrath, M.G.; Christen, U.; Whitton, J.L. Molecular Mimicry, Bystander Activation, or Viral Persistence: Infections and Autoimmune Disease. Clin. Microbiol. Rev. 2006, 19, 80–94. [Google Scholar] [CrossRef]
10. Caforio, A.L.P.; Mahon, N.; Baig, M.K.; Tona, F.; Murphy, R.T.; Elliott, P.M.; McKenna, W.J. Prospective Familial Assessment in Dilated Cardiomyopathy: Cardiac autoantibodies predict disease development in asymptomatic relatives. Circulation 2007, 115, 76–83. [Google Scholar] [CrossRef]
11. Matsui, S.; Fu, M.L.; Katsuda, S.; Hayase, M.; Yamaguchi, N.; Teraoka, K.; Kurihara, T.; Takekoshi, N.; Murakami, E.; Hoebeke, J.; et al. Peptides Derived from Cardiovascular G-protein-coupled Receptors Induce Morphological Cardiomyopathic Changes in Immunized Rabbits. J. Mol. Cell. Cardiol. 1997, 29, 641–655. [Google Scholar] [CrossRef] [PubMed]
12. Barda, N.; Dagan, N.; Ben-Shlomo, Y.; Kepten, E.; Waxman, J.; Ohana, R.; Hernán, M.A.; Lipsitch, M.; Kohane, I.; Netzer, D.; et al. Safety of the BNT162b2 mRNA COVID-19 Vaccine in a Nationwide Setting. N. Engl. J. Med. 2021, 385, 1078–1090. [Google Scholar] [CrossRef] [PubMed]
13. Marom, T.; Tshori, S.; Shefer, G.; Pitaro, J. Pneumococcal Conjugated Vaccines Decreased Acute Otitis Media Burden: A Population-Based Study in Israel. J. Pediatr. 2021, 235, 233–238.e3. [Google Scholar] [CrossRef] [PubMed]
14. Lo, A.W.; Tang, N.L.; To, K.-F. How the SARS coronavirus causes disease: Host or organism? J. Pathol. 2006, 208, 142–151. [Google Scholar] [CrossRef] [PubMed]
15. Kyuwa, S.; Yamaguchi, K.; Toyoda, Y.; Fujiwara, K. Induction of self-reactive T cells after murine coronavirus infection. J. Virol. 1991, 65, 1789–1795. [Google Scholar] [CrossRef] [PubMed]
16. Salmi, A.; Ziola, B.; Hovi, T.; Reunanen, M. Antibodies to coronaviruses OC43 and 229E in multiple sclerosis patients. Neurology 1982, 32, 292–295. [Google Scholar] [CrossRef]
17. Lardans, V.; Godfraind, C.; Van Der Logt, J.T.M.; Heessen, F.W.A.; Gonzalez, M.-D.; Coutelier, J.-P. Polyclonal B lymphocyte activation induced by mouse hepatitis virus A59 infection. J. Gen. Virol. 1996, 77, 1005–1009. [Google Scholar] [CrossRef]
18. Lu, R.; Zhao, X.; Li, J.; Niu, P.; Yang, B.; Wu, H.; Wang, W.; Song, H.; Huang, B.; Zhu, N.; et al. Genomic characterisation and epidemiology of 2019 novel coronavirus: Implications for virus origins and receptor binding. Lancet 2020, 395, 565–574. [Google Scholar] [CrossRef]
19. Le Bert, N.; Tan, A.T.; Kunasegaran, K.; Tham, C.Y.L.; Hafezi, M.; Chia, A.; Chng, M.H.Y.; Lin, M.; Tan, N.; Linster, M.; et al. SARS-CoV-2-specific T cell immunity in cases of COVID-19 and SARS, and uninfected controls. Nature 2020, 584, 457–462. [Google Scholar] [CrossRef]
20. Su, Y.; Yuan, D.; Chen, D.G.; Ng, R.H.; Wang, K.; Choi, J.; Li, S.; Hong, S.; Zhang, R.; Xie, J.; et al. Multiple early factors anticipate post-acute COVID-19 sequelae. Cell 2022, 185, 881–895.e20. [Google Scholar] [CrossRef]
21. Late-Breaking Science Abstracts and Featured Science Abstracts From the American Heart Association’s Scientific Sessions 2020 and Late-Breaking Abstracts in Resuscitation Science From the Resuscitation Science Symposium 2020. Circulation 2020, 142, e470–e500. [CrossRef]
22. Montero, F.; Martínez-Barrio, J.; Serrano-Benavente, B.; González, T.; Rivera, J.; Collada, J.M.; Castrejón, I.; Álvaro-Gracia, J. Coronavirus disease 2019 (COVID-19) in autoimmune and inflammatory conditions: Clinical characteristics of poor outcomes. Rheumatol. Int. 2020, 40, 1593–1598. [Google Scholar] [CrossRef]
23. Tan, C.; Zheng, X.; Sun, F.; He, J.; Shi, H.; Chen, M.; Tu, C.; Huang, Y.; Wang, Z.; Liang, Y.; et al. Hypersensitivity may be involved in severe COVID-19. Clin. Exp. Allergy 2021, 52, 324–333. [Google Scholar] [CrossRef] [PubMed]
24. Yu, L.; Feng, Z. The Role of Toll-Like Receptor Signaling in the Progression of Heart Failure. Mediat. Inflamm. 2018, 2018, 9874109. [Google Scholar] [CrossRef] [PubMed]
25. Saad, M.A.; Alfishawy, M.; Nassar, M.; Mohamed, M.; Esene, I.N.; Elbendary, A. COVID-19 and Autoimmune Diseases: A Systematic Review of Reported Cases. Curr. Rheumatol. Rev. 2021, 17, 193–204. [Google Scholar] [CrossRef]
26. Puntmann, V.O.; Carerj, M.L.; Wieters, I.; Fahim, M.; Arendt, C.; Hoffmann, J.; Shchendrygina, A.; Escher, F.; Vasa-Nicotera, M.; Zeiher, A.M.; et al. Outcomes of Cardiovascular Magnetic Resonance Imaging in Patients Recently Recovered From Coronavirus Disease 2019 (COVID-19). JAMA Cardiol. 2020, 5, 1265–1273. [Google Scholar] [CrossRef]
27. Tereshchenko, L.G.; Bishop, A.; Fisher-Campbell, N.; Levene, J.; Morris, C.; Patel, H.; Khan, A. Risk of Cardiovascular Events after COVID-19: A double-cohort study. medRxiv 2021. [Google Scholar] [CrossRef]
28. Huang, L.; Zhao, P.; Tang, D.; Zhu, T.; Han, R.; Zhan, C.; Liu, W.; Zeng, H.; Tao, Q.; Xia, L. Cardiac Involvement in Patients Recovered From COVID-2019 Identified Using Magnetic Resonance Imaging. JACC Cardiovasc. Imaging 2020, 13, 2330–2339. [Google Scholar] [CrossRef]
Rali, A.S.; Ranka, S.; Shah, Z.; Sauer, A.J. Mechanisms of Myocardial Injury in Coronavirus Disease 2019. Card. Fail. Rev. 2020, 6, e15. [Google Scholar] [CrossRef]
Xie, Y.; Xu, E.; Bowe, B.; Al-Aly, Z. Long-term cardiovascular outcomes of COVID-19. Nat. Med. 2022, 28, 583–590. [Google Scholar] [CrossRef]