V živote a vo vede majú zmeny svoje dôsledky. Pri spätnom pohľade sú tie zlé ľahko viditeľné, môže niekto namietať. Keď však skúmame prirodzené dôsledky zmien v oblasti vedy o vakcínach proti Covidu, nemožno si odpustiť otázku: Určite musel niekto varovať, aby sme to nerobili? Samozrejme, že sa sluší na tomto mieste uviesť, skôr než začneme skúmať tieto dôsledky: práve preto sa majú nové lieky/vakcíny dôkladne testovať predtým, než sa podajú veľkým populáciám.
V roku 2005 doktori Weissman a Karikó objavili spôsob, ako ochrániť cudziu mRNA pred imunitným systémom tela. Tento vedecký míľnik bol kľúčový pre napredovanie mRNA vakcín v roku 2020.
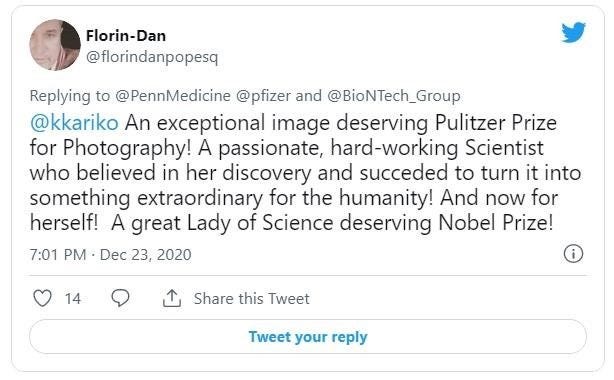
Pennsylvánska univerzita nedávno na Twitteri zverejnila fotografiu, na ktorej doktori Weissman a Kariko dostávajú očkovanie proti Covidu a pripomínajú nám tento míľnik. Jeden z tweetov komentoval, že by mali za svoj objav dostať Nobelovu cenu.
Doktori Drew Weissman a Katalin Karikó – ktorých objav mRNA na @PennMedicine pomohol vydláždiť cestu vakcínam #COVID19 – dostali prvú dávku
@pfizer/@BioNTech_Group injekcie spoločne. Hovoria: "Prínos je obrovský a riziko je malé alebo žiadne." http://spr.ly/6013HrOSP
Florin-Dan
@florindanpopesq
Výnimočná snímka, ktorá si zaslúži Pulitzerovu cenu za fotografiu! Vášnivá, pracovitá vedkyňa, ktorá verila svojmu objavu a podarilo sa jej ho premeniť na niečo výnimočné pre ľudstvo! A teraz aj pre seba! Veľká dáma vedy, ktorá si zaslúži Nobelovu cenu!
Zásadná zmena, ktorú objavili Weissman a Karikó, spočívala v tom, že modifikácia nukleozidov mohla ochrániť mRNA pred imunitnou obranou organizmu.
Potlačenie rozpoznávania RNA receptormi podobnými Toll: vplyv nukleozidovej modifikácie a evolučný pôvod RNA
DNA a RNA stimulujú vrodený imunitný systém cicavcov prostredníctvom aktivácie receptorov podobných Toll (TLR).** DNA obsahujúca metylované motívy CpG však nie je stimulačná. Vybrané nukleozidy v prirodzene sa vyskytujúcej RNA sú tiež metylované alebo inak modifikované, ale imunomodulačné účinky týchto zmien nie sú overené.
***Ukazujeme, že RNA signalizuje prostredníctvom ľudských TLR3, TLR7 a TLR8, ale inkorporácia modifikovaných nukleozidov m5C, m6A, m5U, s2U alebo pseudouridínu znižuje aktivitu.***
Dendritické bunky (DC) vystavené takto modifikovanej RNA exprimujú výrazne menej cytokínov a aktivačných markerov ako tie, ktoré boli ošetrené nemodifikovanou RNA. DC a bunky exprimujúce TLR sú silne aktivované bakteriálnou a mitochondriálnou RNA, ale nie celkovou RNA cicavcov, ktorá je bohatá na modifikované nukleozidy. Dospeli sme k záveru, že nukleozidové modifikácie potláčajú potenciál RNA aktivovať DC. Vrodený imunitný systém preto môže detekovať RNA bez nukleozidovej modifikácie ako prostriedok selektívnej reakcie na baktérie alebo nekrotické tkanivo.
**Receptory podobné Toll sú skupinou proteínov, ktoré zohrávajú kľúčovú úlohu vo vrodenom imunitnom systéme. Sú to jednopriechodové membránové receptory zvyčajne exprimované na sentinelových bunkách, ako sú makrofágy a dendritické bunky, ktoré rozpoznávajú štruktúrne zachované molekuly pochádzajúce z mikróbov
Ich kľúčový objav, že úpravou kódu RNA (modifikáciou nukleozidu uridínu) došlo k zrušeniu vrodenej imunitnej odpovede, sa týkal receptorov podobných Toll (TLR).
Tento objav bol prevzatý v technológii mRNA používanej v kovidových vakcínach, aby sa cudzorodá mRNA vakcíny mohla dostať do buniek bez toho, aby bola zničená.
Nižšie je uvedený kód mRNA z vakcíny Pfizer, ktorý demonštruje modifikovaný nukleozid uridín tým, že ho označuje ako Ψ (modifikovaný) namiesto jeho prirodzenej formy U (uridín). Aby sme boli presní: každý uridín (U) bol nahradený 1-metyl-3'-pseudouridylylom (Ψ).
Úpravou Uridínu v kóde mRNA vakcíny Pfizer je cudzorodá mRNA schopná obísť časť prvej obrannej línie organizmu – vrodený imunitný systém
Telo má dve široké časti imunitného systému: vrodený a špecifický. Vrodený systém ako prvý vstupuje do akcie proti cudzím votrelcom vrátane cudzej mRNA z vakcíny.
Ako sa to dosiahne jednoduchým odstránením jedného písmena kódu z mRNA? Robí to tak, že ovplyvňuje receptory podobné Toll (TLR), čo je poplašný signál vrodeného imunitného systému.
Kaskáda Toll podobných receptorov 7/8 (TLR7/8)
RNA môže slúžiť ako signál nebezpečenstva, a to v dvojvláknovej forme, ako aj v jednovláknovej RNA (ssRNA). Toll like receptor 7 (TLR7) a TLR8 sú endozomálne receptory, ktoré vnímajú ssRNA oligonukleotidy obsahujúce sekvencie bohaté na guanozín (G) a uridín (U) z RNA vírusov (Jurk M et al. 2002; Heil F et al. 2004; Diebold SS et al. 2004; Li Y et al. 2013; prehľad v Lester SN & Li K 2014). TLR7 je exprimovaný predovšetkým v plazmocytoidných dendritických bunkách (pDC) a do určitej miery v B bunkách, monocytoch a makrofágoch, zatiaľ čo TLR8 je exprimovaný najmä v monocytoch, makrofágoch a myeloidných DC. Po zasiahnutí ssRNA v endozómoch TLR7/8 iniciujú cestu závislú od myeloidného diferenciačného faktora 88 (MyD88), ktorá sa končí syntézou IFN typu I a typu III a prozápalových mediátorov prostredníctvom aktivácie regulačného faktora IFN 7 (IRF7) a NF-κB v závislosti od typu bunky (prehľad v Lester SN & Li K 2014). TLR7 a TLR8 sú schopné detegovať sekvencie ssRNA bohaté na GU z vírusových genómov chrípky, vírusu ľudskej imunodeficiencie-1 (HIV-1), vírusu vezikulárnej stomatitídy (VSV), vírusu coxsackie B, koronavírusu a flavivírusov (vírus hepatitídy C, HCV a vírusu západonílskej horúčky, WNV; prehľad v Lester SN & Li K 2014). Konkrétne oligonukleotidy ssRNA bohaté na GU odvodené napríklad od HIV-1 stimulujú dendritické bunky (DC) a makrofágy k vylučovaniu interferónu alfa a prozápalových, ako aj regulačných cytokínov (Heil F et al. 2004). Zistilo sa, že to sprostredkúva TLR7, ako aj TLR8. Podobne aj GU ssRNA bohaté na koronavírus typu 1 (SARS-CoV-1) spojené s ťažkým akútnym respiračným syndrómom mali silné imunostimulačné aktivity v mononukleárnych fagocytoch, ktoré indukovali značnú úroveň uvoľňovania prozápalových cytokínov TNF-a, IL-6 a IL-12 prostredníctvom TLR7 a TLR8 (Li Y et al. 2013). Ďalej myši s nedostatkom buď Tlr7, alebo adaptorového proteínu TLR Myd88 vykazovali zníženú odpoveď na in vivo infekciu VSV (Lund JM et al. 2004), myšou adaptovaný SARS-CoV-1 (Sheahan et al. 2008; Totura et al., 2015). Po infekcii koronavírusom súvisiacim s blízkovýchodným respiračným syndrómom (MERS-CoV) viedol nedostatok signalizácie MyD88 k oneskorenému odstráneniu vírusu a zvýšenej pľúcnej patológii u myší (Zhao et al. 2014). V súlade s tým iná štúdia ukázala, že myši Tlr7-/- majú zníženú expresiu IFN v porovnaní s myšami divokého typu (Channappanavar et al. 2019). Okrem toho varianty straty funkcie TLR7 identifikované u pacientov so SARS-CoV-2 (COVID-19) viedli k defektnej regulácii génov súvisiacich s IFN typu I v dráhe TLR7 (obrázok 3) v odpovedi na agonistu TLR7 imiquimod v porovnaní s kontrolami (Van der Made CI et al. 2020). Samostatné štúdie ukázali, že syntetické imidazochinolínové zlúčeniny (napr. imiquimod a R-848, nízkomolekulové modifikátory imunitnej odpovede, ktoré môžu indukovať syntézu interferónu alfa) tiež uplatňujú svoje účinky spôsobom závislým od MyD88 prostredníctvom TLR7 alebo TLR8 (Hemmi H et al. 2002; Jurk M et al. 2002; Diebold SS et al. 2004). Niektoré vírusy využívajú viacero stratégií, aby sa vyhli antivírusovej signalizácii vrodenej imunity, ako je to vidieť pri koronavírusoch chrípky alebo SARS. Napríklad TLR7 sprostredkovaná vrodená imunita bola spojená s negatívnou reguláciou prostredníctvom odstránenia polyubikvitínových reťazcov TRAF3/TRAF6 viazaných na Lys63 katalytickou doménou proteázy podobnej papínu (PLpro) nsp3 zo SARS-CoV-1 (Li SW et al. 2016). TLR7 a TLR8 teda zohrávajú rozhodujúcu úlohu pri detekcii vírusovej ssRNA v endozóme.
Kľúčové ovplyvnené TLR sú TLR 3, TLR 7 a TLR 8. Fungujú ako strážcovia, ktorých úlohou je rozpoznať cudzích útočníkov podľa ich formy alebo vzorov; trochu ako letecký pozorovateľ v druhej svetovej vojne. Ak sa na oblohe rozpozná nesprávny typ tvaru, spustí sa poplach a spustí sa protilietadlová paľba. V prípade TLR sa aktivuje imunitný systém.
Čo keby ste mohli obísť týchto pozorovateľov? Žiadne poplašné signály, žiadna reakcia imunitného systému; a váš náklad, v tomto prípade cudzia mRNA, bezpečne prejde. Potom má váš liek/vakcína oveľa väčšiu šancu na účinok.
V tomto bode pôvodných experimentov, ktorých cieľom bolo zistiť, ako vypnúť receptory podobné toll (a následne pri navrhovaní vakcín), sa mala položiť otázka: aké dôsledky by malo vypnutie tohto dôležitého systému včasného varovania?
Ak aj bola táto otázka položená, zdá sa, že zostala nepovšimnutá a nebola zodpovedaná až do súčasnosti.
Aberantná imunitná reakcia
Dominguez-Andres a kol. sa touto otázkou zaoberali 6. mája 2021. Uvádzajú:
Niektoré vakcíny, ako napríklad vakcína Bacillus Calmette-Guérin (BCG) a vakcína proti osýpkam, príušniciam a ružienke (MMR), tiež vyvolávajú dlhodobé funkčné preprogramovanie buniek vrodeného imunitného systému. (Netea et al., 2020). Tento biologický proces sa označuje aj ako trénovaná imunita, keď zahŕňa zvýšenú reaktivitu, alebo vrodená imunitná tolerancia, keď je charakterizovaná zníženou produkciou cytokínov (Ifrim et al., 2014). Hoci tieto účinky boli dokázané najmä v prípade živých oslabených vakcín, snažili sme sa zistiť, či vakcína BNT162b2 [Pfizer] môže tiež vyvolať účinky na vrodené imunitné odpovede proti rôznym vírusovým, bakteriálnym a hubovým podnetom.
Ich odpoveď?
Vakcína [BNT162b2] tiež modulovala produkciu zápalových cytokínov bunkami vrodenej imunity pri stimulácii špecifickými (SARS-CoV-2) aj nešpecifickými (vírusovými, hubovými a bakteriálnymi) podnetmi. Odpoveď buniek vrodenej imunity na ligandy TLR4 a TLR7/8 bola po vakcinácii BNT162b2 nižšia.
Pokračujú:
[Pozorovali sme významné zníženie produkcie IFN-α vylučovaného po stimulácii poly I:C a R848 po podaní druhej dávky vakcíny. To môže brániť počiatočnej vrodenej imunitnej odpovedi proti vírusu, keďže sa ukázalo, že defekty TLR7 majú za následok a zvýšenú vnímavosť voči COVID-19 u mladých mužov (Van Der Made et al., 2020). Tieto výsledky spoločne dokazujú, že účinky vakcíny BNT162b2 presahujú rámec adaptívneho imunitného systému a môžu modulovať aj vrodené imunitné reakcie.
Z uvedeného vyplývajú tri obavy.
Schopnosť imunitného systému bojovať proti vírusom bola znížená; konkrétne môže byť ovplyvnená schopnosť bojovať proti vírusu SARS-CoV-2;
Vrodená imunitná tolerancia vyvolaná vakcínou môže ovplyvniť iné vakcíny; a napokon
Aké ďalšie časti imunitného systému môžu byť ovplyvnené.
Klinické stopy?
Na sociálnych sieťach a v online časopisoch sa teraz objavujú správy o pacientoch so zhoršením rakoviny po očkovaní proti SARS-CoV-2; titulky ako napr:
• „Zdravá“ mama zomrela na rakovinu, údajne si myslela, že má len vedľajšie účinky vakcíny proti COVID-19
• Vedľajší účinok vakcíny proti COVIDu u tejto ženy viedol k diagnóze rakoviny prsníka v druhom štádiu
Vo vyššie uvedených článkoch sa akýkoľvek kauzálny účinok vakcíny rýchlo odmieta a jedna pacientka chváli vakcínu za záchranu svojho života:
Moseleyová uviedla, že v júli mala naplánované rutinné mamografické vyšetrenie. Ak by sa však nenechala zaočkovať v apríli a neobjavila by zväčšenú lymfatickú uzlinu, jej rakovina by sa mohla rozvinúť skôr, ako by sa zistila. "Očkovacia látka proti COVID-19, poviem – akokoľvek je COVID na nič – ma zachránila," povedala pre Des Moines Register.
Benígna, opuchnutá lymfatická uzlina spôsobená očkovaním ju upozornila, aby skontrolovala príznaky rakoviny, ktoré sa našli. Lekárka vysvetľuje tento jav v sekcii Lifestyle na portáli News.com.au:
Doktorka Laura Essermanová, riaditeľka Centra starostlivosti o prsia Kalifornskej univerzity v San Franciscu, uviedla, že ženy si po očkovaní zamieňali opuchnuté lymfatické uzliny za príznaky rakoviny.
U Moseleyovej to bola náhoda: mala rakovinu.
Existujú skutočné obavy z nárastu rakoviny, nie však v dôsledku očkovania, ale skôr v dôsledku uzavretia a obmedzeného prístupu k lekárskej starostlivosti. Iní však nie sú presvedčení o prevládajúcom naratíve a majú podozrenie, že k tomu prispieva očkovanie proti SARS-CoV-2: Doktor Ryan Cole, patológ, v nedávnej prezentácii uviedol, že po očkovaní proti SARS-CoV-2 zaznamenal 20-násobný nárast rakoviny maternice a nárast iných druhov rakoviny.
A čo je ešte znepokojujúcejšie: starší konzultant, ktorý má za sebou desaťročia diagnostiky a liečby v špecializovanej onkologickej nemocnici, novinárovi mimo záznamu opísal, že všetci jeho očkovaní pacienti s rakovinou sa dostali z remisie; a že rakovina preskakuje medzi orgánmi a šíri sa rýchlosťou, akú nikdy predtým nevidel (pers. Comm.).
V tomto štádiu sú tieto správy anekdotické, ale ak odrážajú doteraz skrytú zmenu v povahe toho, ako rakovina ovplyvňuje pacientov po očkovaní, aký by to bol mechanizmus? A do akej miery by ho mohlo zakryť, aj keď len spočiatku, očakávané zvýšenie chorobnosti a úmrtnosti v dôsledku uzavretia a obmedzeného prístupu k lekárskej starostlivosti?
Bolo by to zaujímavé intelektuálne cvičenie, keby sa nekládla pôvodná otázka, ktorá sa nezdala byť dostatočne položená a zodpovedaná: aké dôsledky by malo vypnutie tohto dôležitého systému včasného varovania? Odpoveď na ňu môže byť len ozvenou zárodočných pozorovaní lekárov, ako je Ryan Cole.
Mechanizmus
Klinická stopa, aj keď v súčasnosti hlásená v malom počte, ktorá možno podporuje prácu Domingueza-Andresa a spol. a môže byť imunologicky spojená s pozorovaniami doktora Colea, sa objavila ako reaktivácia vírusu Varicella Zoster po očkovaní proti Sars-Cov-2:
U siedmich imunokompetentných pacientov vo veku >50 rokov sa objavila infekcia herpes zoster (HZ) v mediáne 9 dní (rozsah 7–20) po očkovaní proti SARS-CoV-2. Výskyt HZ v časovom okne 1–21 dní po očkovaní definovanom pre zvýšené riziko a hlásená účasť T-buniek sprostredkovanej imunity naznačujú, že očkovanie proti COVIDu-19 je pravdepodobnou príčinou HZ.
Údaje boli v súlade s tým, že vakcína spôsobila zmeny v imunitnom systéme, ktoré spôsobili, že príjemca bol náchylnejší na vznik infekcie herpes zoster (HZ).
Furer a kol. v publikácii Herpes zoster following BNT162b2 mRNA COVID-19 vaccination in patients with autoimmune inflammatory rheumatic diseases: a case series (Herpes zoster po očkovaní proti COVIDu-19 mRNA BNT162b2 u pacientov s autoimunitnými zápalovými reumatickými ochoreniami: súbor prípadov) publikovanej v časopise Journal of Rheumatology tiež uviedli:
Potenciálne mechanizmy, ktoré by mohli vysvetliť patogenetické spojenie medzi mRNA očkovaním proti COVIDu-19 a reaktiváciou HZ, súvisia so stimuláciou vrodenej imunity prostredníctvom receptorov podobných mýtu (TLR) 3,7 vakcínami na báze mRNA. Signalizácia TLR bola zapojená počas reaktivácie herpesvírusov, čo je proces nevyhnutný na to, aby sa tieto vírusy udržali v hostiteľovi. Defekty v expresii TLR u pacientov trpiacich ochoreniami spôsobenými priamo infekciou herpesvírusmi poukazujú na dôležitosť týchto signálnych dráh počas infekcie a prípadnej progresie ochorenia. Vakcína stimuluje indukciu INF typu I a silných zápalových cytokínov, ktoré podnecujú imunitné odpovede T a B, ale môžu negatívne ovplyvniť expresiu antigénu, čo potenciálne prispieva k reaktivácii HZ.
Obe vyššie uvedené štúdie, ktoré implikujú časti imunitného systému po vakcinácii proti SARS-CoV-2 v infekcii HZ. Niekto by mohol povedať: no, tieto štúdie majú značný počet starších pacientov; prvá štúdia mala priemerný vek 77 rokov a títo pacienti majú iné zdravotné problémy a môžu existovať aj iné vysvetlenia. Napríklad metotrexát, široko predpisovaný liek na imunitne sprostredkované zápalové ochorenie, ktoré môže súvisieť s vyšším vekom, bol v minulosti spochybňovaný pre svoj vplyv na infekciu HZ, pričom niektoré štúdie potvrdzovali kauzálnu úlohu a iné nie. A nedávno metotrexát významne brzdil imunitný proces po očkovaní vakcínou Pfizer proti Sars-Cov-2. Zdá sa však, že pacienti v reaktivačnej štúdii tento liek neužívali.
Musíme tiež poznamenať, že infekcia HZ bola pozorovaná aj v prípadoch Covid-19, a to nielen u starších ľudí:
Zatiaľ čo sa vyskytli prípady reaktivácie vírusu varicella zoster v dôsledku očkovania vakcínou proti COVIDu-19 alebo COVIDom-19 u starších osôb s už existujúcimi ochoreniami, táto kazuistika opisuje prvý prípad reaktivácie vírusu varicella-zoster u zdravého, mladého muža bez už existujúcich ochorení. Mechanizmy, ktoré sú základom reaktivácie vírusu varicella zoster u pacientov s vakcínou proti COVIDu-19, nie sú známe a mali by sa ďalej charakterizovať.
Preto sa infekcia Covid-19 aj očkovanie proti SARS-CoV-2 spájajú s infekciou HZ. Koľko ďalších ľudí malo podobnú reakciu, ale zostala neidentifikovaná?
Je skutočne potrebné charakterizovať mechanizmus a zahŕňa dysfunkčné TLR? Uvedené štúdie si to myslia a obviňujú stimuláciu špecifických TLR.
TLR skutočne zohrávajú dôležitú úlohu pri herpetickej infekcii; a TLR2, 3 a 9 konkrétne pri infekcii Varicella Zoster; a akákoľvek potenciálna zmena ich funkcie preto môže ovplyvniť schopnosť organizmu kontrolovať infekciu HZ.
Hoci výskum nepreukázal účinky po očkovaní na TLR2 a 9 (pozri nižšie TLR3), pripomíname vyhlásenie Domingueza-Andresa a kol. týkajúce sa ostatných TLR:
Po očkovaní vakcínou BNT162b2 bola odpoveď buniek vrodenej imunity na ligandy TLR4 a TLR7/8 nižšia.
Zaznamenali aj zmeny v TLR3, ktorý sa špecifickejšie podieľa na infekcii Varicella Zoster, ale nedosiahli štatistickú významnosť:
Produkcia TNF-α po stimulácii agonistom TLR7/8 R848 mononukleárnych buniek periférnej krvi dobrovoľníkov bola po druhom očkovaní významne znížená. Rovnaký trend sa pozoroval po stimulácii agonistom TLR3 poly I:C, hoci rozdiel nedosiahol štatistickú významnosť.
Z uvedeného výskumu vidíme, že vedci sa obávajú, že časti imunitného systému sú negatívne ovplyvnené infekciou Covid-19 aj očkovaním proti SARS-CoV-2, čo môže viesť k reaktivácii infekcie Varicella. Predpokladá sa stimulácia receptorov podobných toll, ale implicitný dizajn mRNA vakcín SARS-CoV-2 je taký, že bude menej stimulovať určité receptory podobné toll; TLR 7 a 8 sú RNA senzory a boli by ovplyvnené zmenami uridínu mRNA vakcíny. TL4 nie.
Bez ohľadu na to výskumníci preukázali, že odpoveď buniek vrodenej imunity na ligandy TLR4 a TLR7/8 bola po očkovaní BNT162b2 nižšia. A to nie je pre vrodenú imunitnú odpoveď dobré.
Dysregulácia imunitného systému
Imunitný systém je vysoko regulovaný so vzájomne prepojenými cestami, ktoré imunológovia stále objavujú, a zmenou jednej časti ovplyvníte inú. Ak očkovanie proti SARSCoV-2 mení niečo v našom imunitnom systéme, či už prostredníctvom zmien v kóde mRNA vakcíny a negatívneho ovplyvnenia receptorov podobných toll alebo iným spôsobom, čo ešte mení v našej imunite?
Určitú indíciu sme už videli vo výskume, ktorému sme sa venovali, ale aby sme to rozvinuli, uvažujme o nasledujúcom:
Lynn a kol. opisujú význam receptorov podobných tollovým receptorom v článku Impact of Polymer-TLR-7/8 Agonist (Adjuvant) Morphology on the Potency and Mechanism of CD8 T Cell Induction (Vplyv morfológie polymérneho agonistu TLR-7/8 (adjuvans) na účinnosť a mechanizmus indukcie CD8 T buniek):
Malé molekuly agonistov TLR7 a -8 (TLR-7/8a) sa môžu použiť ako adjuvans vakcíny na indukciu bunkovej imunity CD8 T buniek.
InvivoGen sumarizujúci Craft et al (2005) & Reece et al (2005) podporujú toto zistenie:
Schopnosť agonistov TLR7-8 aktivovať DC, a tým vyvolať reakcie Th1 a CD8+ T-buniek, možno využiť na zvýšenie účinnosti očkovania.
Od týchto autorov vidíme dôležité prepojenie medzi receptormi podobnými toll, dendritickými bunkami (DC) a T bunkami, konkrétne T bunkami CD8.
Toll-like receptory aktivujú dendritické bunky a vyvolávajú odpoveď T buniek CD8. Bunky CD8 T sú považované za dôležitú súčasť obrany imunitného systému proti infekciám, ale aj proti rakovine.
Fu a Jiang v práci Dendritické bunky a imunita CD8 T buniek v mikroprostredí nádoru ďalej skúmajú túto zložitú súhru a odhaľujú význam dendritických buniek v úlohe, ktorú zohrávajú CD8 T bunky v boji proti rakovine:
Zatiaľ čo priama prezentácia nádorových antigénov na ich MHCI nádorovými bunkami zohráva dôležitú úlohu v efektorovej funkcii CD8 T buniek, krížová prezentácia profesionálnymi antigén prezentujúcimi bunkami, najmä DC, je potrebná na prípravu naivných CD8 T buniek a udržanie cytotoxických imunitných odpovedí.
Ak, ako uvádzajú autori, že na aktiváciu dendritických buniek sú potrebné receptory podobné toll a dendritické bunky udržiavajú cytotoxické zabíjanie T buniek proti rakovinovým nádorom, čo sa stane, ak tieto receptory podobné toll nefungujú tak dobre?
Zvýši sa výskyt rakoviny? A infekcia?
V literatúre sa opisuje, že receptory 7 a 8 podobné toll sú dôležité pri vyvolávaní životne dôležitej odpovede T-buniek CD8. V tejto súvislosti si pripomeňme, čo napísali doktori Weissman a Karikó v roku 2005 v článku Suppression of RNA recognition by Toll-like receptors: the impact of nucleoside modification and the evolutionary origin of RNA:
Ukázali sme, že RNA signalizuje cez ľudské TLR3, TLR7 a TLR8, ale inkorporácia modifikovaných nukleozidov m5C, m6A, m5U, s2U alebo pseudouridínu znižuje aktivitu.
Práve táto technológia sa používa vo vakcínach proti SARS-CoV-2: Vypína signalizáciu TLR 7 a 8, ktorú imunitný systém potrebuje na boj proti infekcii a rakovine.
Z H R N U T I E
Zmeny kľúčových častí mRNA kódu vo vakcínach proti SARS-CoV-2 môžu byť príčinou zmeny vrodenej imunitnej odpovede prostredníctvom receptorov podobných toll. TLR sú dôležitými zložkami v obrane proti infekcii a následné účinky môžu zahŕňať aj inhibíciu odpovede CD8 T buniek. CD8 je dôležitou súčasťou schopnosti imunitného systému likvidovať infekcie a rakovinu. Tieto zmeny sa môžu prejaviť v nedávnych reaktivovaných infekciách Varicella Zoster, hoci špecifické mechanizmy sú v súčasnosti nejasné. Neoficiálne správy o výraznom náraste výskytu rakoviny u lekárskych konzultantov môžu byť v súlade s aberantnými zmenami TLR a dendritických buniek, ktoré vedú k inhibícii protinádorovej efektorovej odpovede CD8. Sú potrebné ďalšie údaje, ale perspektíva zmenenej odpovede CD8 na infekciu a rakovinu je veľmi znepokojujúca a mala by sa urýchlene prešetriť.
Určite musel niekto varovať pred takýmto postupom – a nie je presne toto dôvod, prečo sa majú nové lieky/vakcíny dôkladne testovať predtým, ako sa podajú veľkej časti populácie?