Spike proteín a degradácia IRF3: cesta k pretrvávajúcej expresii SP a mitochondriálnym ochoreniam
Pochopenie prítomnosti spike proteínu u osôb s dlhým COVID a u osôb s poškodením spike proteínom
Walter M Chesnut, 26. marca 2023
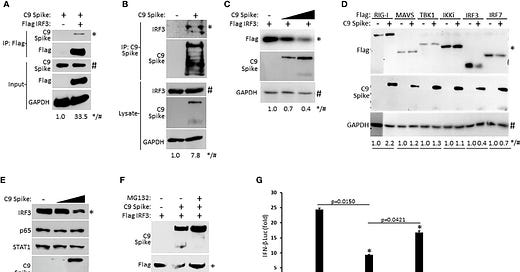
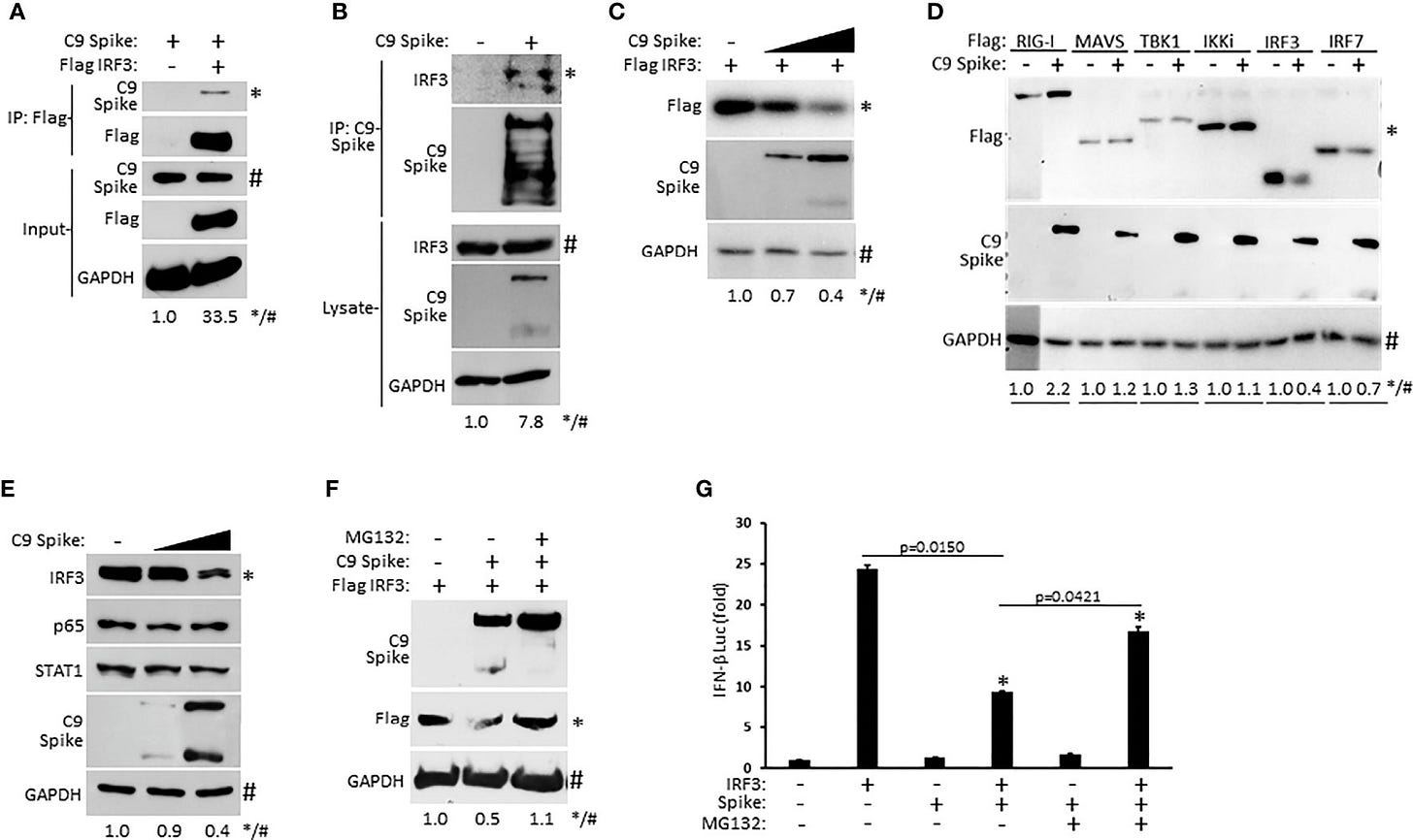
SARS-CoV-2 Spike interaguje s IRF3 a sprostredkúva jeho proteazomálnu degradáciu. (A) Ko-imunoprecipitácia a imunoblot vlajkového IRF3 (1 µg) s C9 Spike (1 µg) ko-transfundovaného v bunkách HEK 293T. (B) Imunoprecipitácia a imunoblot transfekovaného C9 Spike (1 µg) s IRF3 v bunkách HEK 293T ošetrených MG132 (10 µM) počas 4 hodín. (C) Imunoblotová analýza markera IRF3 (250 ng) ko-transfekovaného s C9 Spike (500 ng a 1 μg) v bunkách HEK293T. (D) Imunoblotová analýza markera RIG-I, MAVS, TBK1, IKKi, IRF3 a IRF7 (po 1 µg) ko-transfekovaných s C9 Spike (2 µg) v bunkách HEK 293T. (E) Imunoblotová analýza IRF3, p65 a STAT1 v bunkách HEK 293T transfekovaných s C9 Spike (500 ng a 1 µg). (F) Imunoblotová analýza IRF3 markera (1 µg) ko-transfekovaného s C9 Spike (2 µg) v bunkách HEK 293T a následne ošetreného MG132 (10 µM) alebo bez neho. GAPDH slúži ako kontrola zaťaženia. (G) Reporterové testy IFN-β luciferázy v bunkách HEK 293T ko-transfekovaných plazmidmi kódujúcimi IRF3 (500 ng) a C9 Spike (1 µg), po ktorých nasledovalo ošetrenie MG132 (20 µM) počas 4 h. * Označuje p< 0,05, ako bolo stanovené študentským t-testom. Výsledky sú reprezentatívne pre dva nezávislé experimenty. Relatívna intenzita pásov (*/#) koimunoprecipitovaného markera IRF3 v (A), koimunoprecipitovanej endogénnej IRF3 v (B), markera IRF3 v (C, F), RIG-I, MAVS, TBK1, IKKi, IRF3 a IRF7 v (D) a endogénnej IRF3 v (E) sa merala pomocou softvéru ImageJ.
PREDSLOV: Domnievam sa, že všetci jedinci prijatí do nemocnice by mali byť vyšetrení na prítomnosť spike proteínu. Mali by sme tiež vykonávať hromadný skríning jedincov na prítomnosť SP. Získané údaje sú s najväčšou pravdepodobnosťou rozhodujúce pre pochopenie súčasnej celosvetovej pandémie nadmernej úmrtnosti.
V článku uverejnenom v januári minulého roka sa zistilo, že spike proteín podporuje degradáciu IRF3.
Zistili sme, že SARS-CoV-2 Spike interaguje s IRF3 a ďalej podnecuje jeho proteazomálne sprostredkovanú degradáciu s cieľom ukončiť aktiváciu IFN-I. SARS-CoV-2 Spike sa skladá z domény S1 a S2, kde si vstup SARS-CoV-2 vyžaduje proteolytické štiepenie na týchto miestach (Huang et al., 2020). V mnohých našich imunoblotových experimentoch, ktoré skúmali ektopickú expresiu Spike, sme zaznamenali detekciu Spike v plnej dĺžke, ako aj rýchlejšie migrujúcej, ale menej intenzívnej domény S2.
SARS-CoV-2 Spike antagonizuje vrodenú protivírusovú imunitu tým, že sa zameriava na interferónový regulačný faktor 3
https://www.frontiersin.org/articles/10.3389/fcimb.2021.789462/full
V článku sa nehovorí o tom, čo je podľa mňa mimoriadne dôležité, a to, že neprítomnosť IRF3 umožňuje, aby boli bunky trvalo infikované a naďalej exprimovali vírus A VÍRUSOVÉ ČASTICE.
Interferónový regulačný transkripčný faktor 3 (IRF3) je transkripčný faktor, ktorý po aktivácii vírusovou infekciou podporuje syntézu antivírusových génov, ako sú interferóny (Hiscott, 2007). Okrem indukcie génov IRF3 spúšťa antivírusovú apoptózu cestou apoptózy sprostredkovanej IRF3 receptorom podobným RIG-I (RIG-I-like receptor-induced IRF3 mediated pathway of apoptosis – RIPA), ktorá je nezávislá od jeho transkripčnej aktivity. RIPA chráni pred smrteľnou vírusovou infekciou buniek u myší (Chattopadhyay et al., 2016). Pri absencii RIPA, spôsobenej genetickou abláciou, chemickou mutagenézou alebo inhibíciou receptora rozpoznávania vzorov (pattern recognition receptor – PRR) indukovaného génom I pre kyselinu retinovú (RIG-I), infekcia vírusom Sendai (SeV) nespúšťa bunkovú apoptózu a stáva sa perzistentne infikovanou (Peters et al., 2008; Chattopadhyay et al., 2013).
Všimnite si toto veľmi dôležité zistenie:
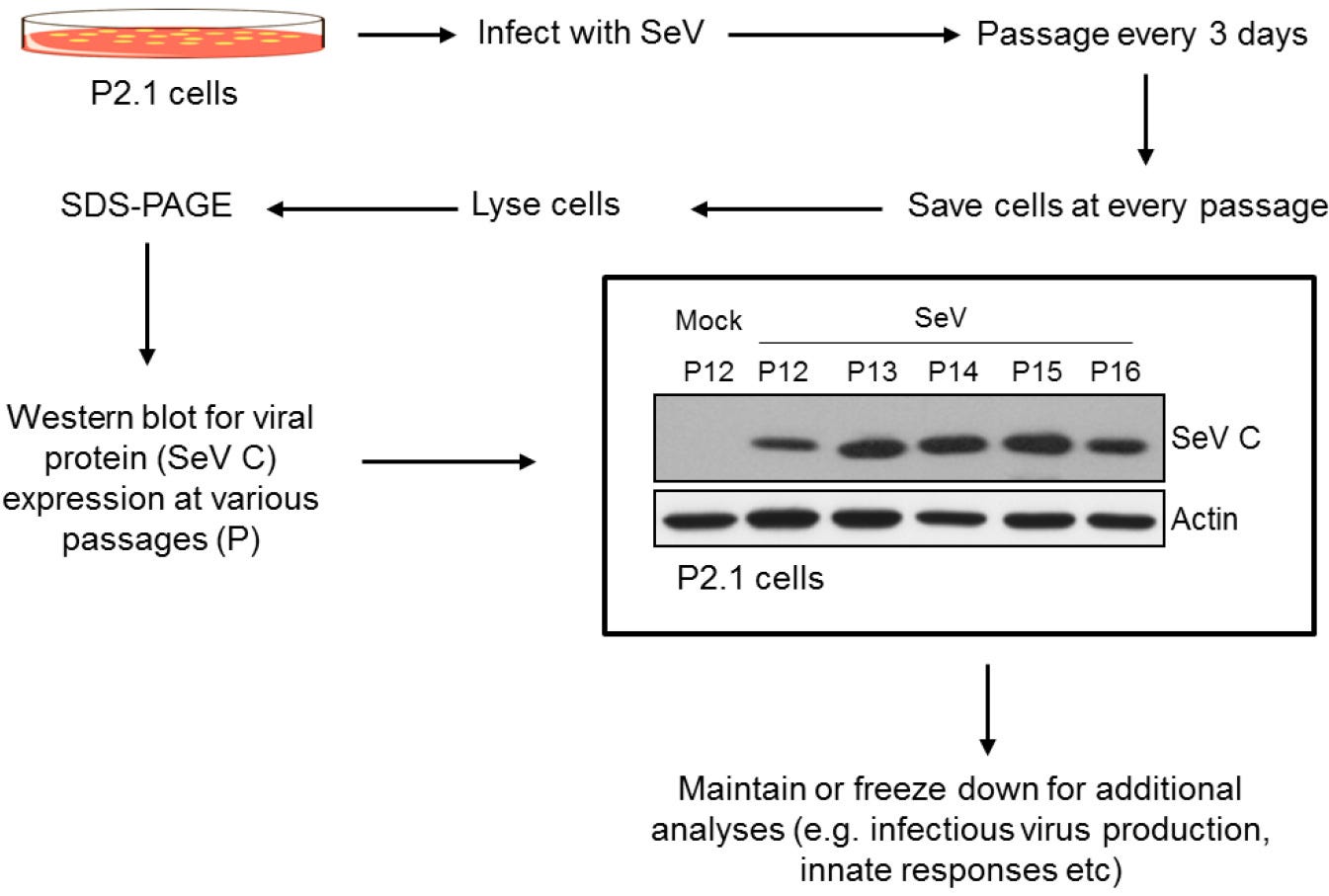
Tu uvádzame podrobný postup vývoja perzistentne infikovanej ľudskej bunkovej línie SeV (obrázok 2), ktorá nepretržite exprimuje vírusový proteín a produkuje nízke hladiny infekčných vírusových častíc.
Obr. 2: Vývoj perzistentných bunkových línií SeV s použitím rodičovských buniek P2.1
MITOCHONDRIÁLNA IMPLIKÁCIA, POŠKODENIE/OCHORENIE SPIKE PROTEÍNOM A DLHÝ KOVID
Ďalším veľmi dôležitým pozorovaním, ktoré treba zvážiť, je, že degradácia IRF3 vyvolaná spike proteínom umožňuje "chorým" bunkám nielen produkovať Spike, ale aj nezomierať a nefungovať. Domnievam sa, že toto je jadro dlhého COVIDu a poškodenia/choroby spike proteínu. Ak mitochondrie nepovedia infikovanej bunke/továrni na spike proteín, aby zomrela, nielenže bude naďalej exprimovať Spike, ale bude aj naďalej dysfunkčná. Je zrejmé, že keď v nejakom orgáne nefunguje dostatočný počet buniek, tento orgán nefunguje.
IRF3 je tiež rozhodujúci pre spustenie apoptózy odlišnou cestou, ktorá si nevyžaduje jeho transkripčnú aktivitu. V sérii predchádzajúcich štúdií sme objavili cestu, ktorú sme nazvali RIPA, ktorá spúšťa apoptózu v bunkách infikovaných vírusom. V RIPA IRF3 interaguje s proteínom BCL-2-Associated X (BAX), proapoptotickým faktorom (Chattopadhyay et al., 2010). Po naviazaní na BAX sa IRF3 premiestni do mitochondrií a spustí signalizačnú kaskádu, ktorá v konečnom dôsledku podporuje apoptózu (Chattopadhyay et al., 2010). V neprítomnosti IRF3 alebo iných zložiek RIPA bunky pri infekcii vírusom Sendai (SeV) vytvárajú vírusovú perzistenciu (Peters et al., 2008; Chattopadhyay et al., 2013).
Vytvorenie ľudskej bunkovej línie perzistentne infikovanej vírusom Sendai
https://en.bio-protocol.org/en/bpdetail?id=2512&type=0
Možno ďalším účinným terapeutickým prostriedkom proti vírusu Spike a SARS-CoV-2 by bolo vyvolanie upregulácie IRF3. To by mohlo odstrániť vírus (a samozrejme aj Spike) z tela.