Přepracování analýzy společností Pfizer a Moderna
Hrdinský pokus Petera Doshiho a jeho kolegů o opětovnou analýzu studií fáze 3
Substack, Robert W Malone MD, MS, 23. června 2022 —> https://tinyurl.com/36wsumnj
V poslední době se objevilo trochu rozruchu v souvislosti se zveřejněním preprintu (ještě nerecenzovaného) článku s názvem "Serious Adverse Events of Special Interest Following mRNA Vaccination in Randomized Trials" (Závažné nežádoucí příhody zvláštního významu po očkování mRNA v randomizovaných studiích) na začátku tohoto měsíce.
K popisu zjištění byla použita slova jako "bombastická studie". To zní dost významně a rozhodně to upoutalo mou pozornost. S vedoucím redaktorem BMJ Dr. Peterem Doshim jako hlavním autorem by mohla být! Dr. Doshi má zaslouženou pověst autora nepohodlných pravd. Tak se na to pojďme podívat.
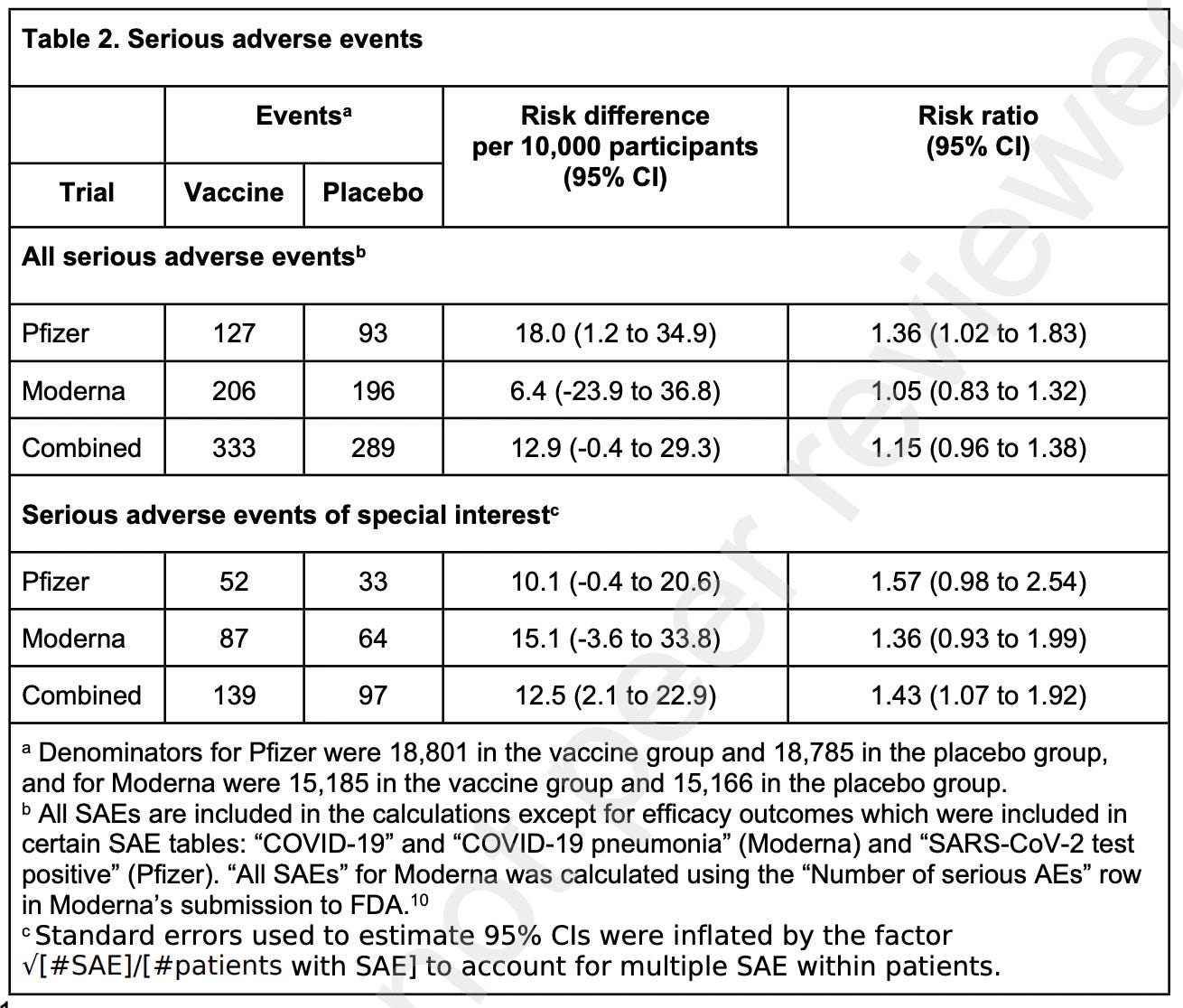
Zde jsou hlavní výsledky z abstraktu:
Vakcíny Pfizer a Moderna mRNA COVID-19 byly spojeny se zvýšeným rizikem závažných nežádoucích účinků zvláštního významu, přičemž absolutní zvýšení rizika činilo 10,1 a 15,1 na 10000 očkovaných oproti základním hodnotám placeba 17,6 a 42,2 (95% CI -0,4 až 20,6 a -3,6 až 33,8).
Kombinované mRNA vakcíny byly spojeny s absolutním zvýšením rizika závažných nežádoucích příhod zvláštního významu o 12,5 na 10000 očkovaných (95% CI 2,1 až 22,9).
Překročení rizika závažných nežádoucích příhod zvláštního významu překročilo snížení rizika hospitalizace u vakcíny COVID-19 oproti skupině s placebem ve studiích Pfizer i Moderna (2,3 a 6,4 na 10000 účastníků).
A sekce diskuze k abstraktu:
"Nadměrné riziko závažných nežádoucích účinků zjištěné v naší studii poukazuje na potřebu formálních analýz škod a přínosů, zejména takových, které by byly stratifikovány podle rizika závažných následků léčby přípravkem proti COVID-19, jako je hospitalizace nebo úmrtí."
Titulky vypadají na první pohled dost vážně. Ale diskusní část by nás měla upozornit, že autoři jsou opatrní. Autoři nesignalizují zjištění typu "kalhoty v ohni".
O co tu ve skutečnosti jde? Abychom to pochopili, je dobré začít tímto úžasně jasným a přesným shrnutím prvních výsledků studie společnosti Pfizer od kanadské organizace COVID Care Alliance (zveřejnění, které je zřejmě prohřeškem, kvůli němuž jsem byl loni v prosinci vyhozen z Twitteru a Linked-In, což mělo za následek, že jsem byl odpojen od asi 600 tisíc sledujících).
Shrnutí této analýzy a zjištění ve formátu PDF najdete také zde.
Pointa je v tom, že studie 3. fáze společnosti Pfizer, kterou NIAID, FDA a CDC použily ke zdůvodnění povolení k mimořádnému použití, je v podstatě nevyžádaná klinická studie, která byla nevhodně zastavena dlouho předtím, než se vůbec přiblížila plánované době sledování, neposkytla dostatečně dlouhou následnou analýzu nežádoucích účinků spojených s očkováním a v níž byla záměrně vyřazena kontrolní skupina. Tím byla v podstatě zmařena jakákoli možnost zjistit, jaká jsou hlavní skutečná rizika očkování mRNA společnosti Pfizer. Pokud jde o méně závažná rizika, studie nebyla dostatečně silná (nebyla dostatečně velká), aby je mohla vyhodnotit.
Do této situace se vložila neohrožená skupina (většinou) starších akademických výzkumníků. Napadá mě rčení "blázni se vrhají tam, kam se andělé bojí vkročit", protože pro každého akademika se stalo nesmírně riskantním zpochybňovat schválený příběh o vakcínách. Ale tato odvážná skupina, která rozhodně není bláznivá, vystoupila.
Podle toho, co jsem si přečetl, jejich přístup k této analýze a zprávě spočíval v tom, že se v dobré víře snažili provést analýzu klinických zkoušek fáze 3 (to mají být ty "velké, konečné" klinické zkoušky před licencováním produktu), které měly provést společnosti Moderna a Pfizer. V podstatě se jedná o analýzu, kterou měl FDA provést sám a k jejímuž provedení měl Modernu a Pfizer donutit. Kdyby personální šéf Bílého domu Mark Meadows nevyvíjel nátlak na FDA, možná by udělal správnou věc. Ale FDA zjevně ustoupila a neudělala svou práci, a tak jsme tady.
V tom je právě ten háček. Nejenže FDA svou práci neudělala, ale ani FDA, ani Moderna, ani Pfizer primární údaje nezveřejní, což znamená, že to nemůže udělat ani nikdo jiný. Jak poznamenávají autoři této nedávné analýzy ve své diskusi:
Mělo by být provedeno systematické přezkoumání a metaanalýza s využitím údajů o jednotlivých účastnících, které by se zabývaly otázkami škodlivosti a prospěšnosti u různých demografických podskupin. K řádnému vyhodnocení těchto otázek je zapotřebí plné transparentnosti údajů z klinických studií vakcíny COVID-19. Bohužel více než rok po širokém použití vakcíny COVID-19 zůstávají údaje na úrovni účastníků nedostupné.
Doshi a jeho kolegové opakovaně vyzývali k úplnému zveřejnění údajů ve dvou předchozích publikacích, avšak bezvýsledně. Pokud tedy nebudou údaje zahrnuty do soudem nařízeného zveřejnění dat, může být analýza, kterou provádějí v současné předtiskové zprávě, tím nejlepším, čeho se dočkáme. Další informace k této problematice naleznete zde
Tanveer S, Rowhani-Farid A, Hong K, Jefferson T, Doshi P. Transparentnost studií vakcíny COVID-19: rozhodnutí bez údajů. BMJ Evid Based Med [Internet]. 2021 Aug 9
Doshi P, Godlee F, Abbasi K. Covid-19 vaccines and treatments: we must have raw data, now. BMJ [Internet]. 2022 Jan 19;376:o102.
Jak vhodně poznamenává Dr. Doshi a jeho kolegové,
V roce 2013 schválily americké a evropské oborové organizace společné prohlášení o sdílení údajů z klinických hodnocení, v němž přijaly řadu závazků, které "uznávají význam sdílení údajů z klinických hodnocení v zájmu pacientů, zdravotní péče a ekonomiky"6. V roce 2015 americký Institute of Medicine podobně podpořil přínosy sdílení údajů z klinických hodnocení, přičemž zdůraznil, že "ověřování a replikace tvrzení zkoušejících" jsou pro vědecký proces zásadní, a upozornil na četné přínosy pro zúčastněné strany "včetně plátců zdravotní péče i pacientů, jejich lékařů a výzkumných pracovníků".
Kdyby však přání byla koněm, žebráci by jezdili na koni. Společnosti Pfizer a Moderna a FDA zjevně nemají v úmyslu vyslyšet výzvy vedoucího redaktora časopisu British Medical Journal, pokud je k tomu nedonutí americké soudy, a i pak budou tahat za nos tak dlouho, jak jen to bude možné. Neumím si představit proč <sarkasmus>.
Přístup, který Dr. Doshi a jeho kolegové zvolili, spočívá v tom, že důsledně sestavili soubor dat, který se co nejvíce blíží tomu, co by mohlo být původní, a to tak, že prošli akademické publikace jednotlivých společností ("sponzorů"), jakož i webové stránky FDA a Health Canada, kde našli všechny tabulky nebo seznamy nežádoucích účinků, které bylo možné získat z veřejných prezentací, a poté je sestavili tak, aby tvořily co nejbližší přiblížení "skutečným" primárním údajům, a poté tyto soubory dat analyzovali.
Kromě časopiseckých publikací jsme prohledali webové stránky FDA (materiály ze zasedání poradního výboru) a Health Canada (části dokumentace předložené sponzory regulačnímu orgánu). V případě webových stránek FDA jsme vzali v úvahu prezentace FDA i sponzorů. V každém z těchto zdrojů jsme vyhledali tabulky s výsledky SAE, které prezentovaly informace podle konkrétního typu SAE; vybrali jsme nejnovější tabulku SAE odpovídající požadavku FDA na bezpečnostní medián doby sledování nejméně 1 měsíc po 2. dávce.
SAE je zkratka pro závažnou nežádoucí příhodu. Všimněte si posledního řádku - dva měsíce po druhé dávce. Z článku v časopise Cell z ledna loňského roku víme, že jak syntetická mRNA, která ve skutečnosti není mRNA, vydrží minimálně 60 dní, tak spike protein vyrobený z této mRNA, takže "lék" je stále přítomen nejméně dva měsíce po 2. dávce. Pravděpodobně by bylo mnohem lepší, kdyby FDA trvala na tom, aby sledování SAE bylo delší než jeden měsíc. Ale spěchali, protože jim to nařídil šéf Trumpova štábu. Takže je to tak. Příčina a následek.
Vrátíme-li se k článku, Doshi a jeho kolegové k provedení svých analýz údajů o nežádoucích příhodách, které se jim podařilo získat, použili seznam "nežádoucích příhod zvláštního významu" (AESI), který byl sestaven CEPI a Brighton Collaboration a poté schválen WHO. Tento seznam byl sestaven před zahájením studie. Nyní zpětně máme k dispozici rozsáhlou tabulku potenciálních AESI od společnosti Pfizer, která byla zřejmě sestavena PO uzákonění povolení k mimořádnému použití, a autoři ji mohli použít. Doshi a spol. se však chovají jako opravdoví skauti a rozhodli se vyhodnotit pouze seznam AESI, který existoval předtím, než byla data ze studie k dispozici pro jejich analýzy, ve své zjevné snaze udělat zpětně to, co mělo být uděláno původně.
Problém je v tom, že ve skutečnosti nemají přístup k údajům na úrovni pacientů, takže museli učinit určité předpoklady o těchto primárních údajích, zejména pokud jde o jejich číselné/statistické rozložení.
Dalším omezením je náš nedostatečný přístup k údajům o jednotlivých účastnících, což nás donutilo použít konzervativní úpravu standardních chyb. Vypočtené 95% CI jsou proto pouze přibližné, protože nevíme, u kterých pacientů došlo k více příhodám. Navíc i přes naši snahu odstranit z analýzy koncové body účinnosti (tj. SAE označené jako COVID-19, COVID-19 pneumonie a "pozitivní test SARS-CoV-2") nebylo možné identifikovat a odstranit SAE, které se vyskytly u pacientů se závažnými komplikacemi COVID-19 (např. akutní respirační selhání, srdeční zástava a akutní poškození ledvin), které jsou časté.
Jinými slovy, udělali to nejlepší, co mohli, ale museli zahrnout některé předpoklady. Zde je tabulka s klíčovými údaji, která je výsledkem celé této náročné práce:
Všimněte si sloupců s poměrem rizik a zejména 95% intervalu spolehlivosti (zkráceně CI). Poměr rizika, kdy jsou kontrolní a experimentální skupina rovnocenné, by byl 1,0. Větší než 1,0 (v tomto případě) by znamenalo, že větší riziko nežádoucích účinků hrozí těm, kteří vakcínu dostali. Kolem tohoto čísla však existuje statistické rozmezí (při náhodném testování a nastavení prahu statistického testu, že v 95 ze 100 případů bude výsledek spadat do tohoto rozmezí). Pokud tedy interval spolehlivosti sahá od menší než jedna do větší než jedna, nelze dojít k závěru, že existuje statistický rozdíl mezi výsledky pro kontrolní skupinu a skupinu léčenou vakcínou. Stejně jako v případě mnoha jiných testů. Nyní jsou všechny dosti vychýlené a pohybují se velmi blízko 1 a větší než 1. To tedy naznačuje, že kdyby byl počet testovaných pacientů větší, mohly by všechny dosáhnout statistické významnosti. Ve skutečnosti se však jedná o skromnou velikost vzorku pro studii vakcíny fáze 3. FDA opět nechal sponzory, aby se z toho vyvlékli, ale tyto údaje jsou k dispozici. A není možné, abychom se někdy vrátili k tomuto bodu v čase, protože v současné době jsou již téměř všichni buď očkováni, nebo nakaženi.
Ve výzkumu vakcín se pro účely odhadu velikosti vzorku studie uplatňuje pravidlo tří. Pokud chcete spolehlivě odhalit nežádoucí příhodu, která se vyskytne jednou za tisíc pacientů, měli byste otestovat 3000 pacientů ve skupině očkovaných. V případě studie společnosti Pfizer je tedy její síla taková, aby odhalila nežádoucí příhody, které se vyskytnou přibližně jednou na (18800/3) = 6266 pacientů. U společnosti Moderna je to (15185/3) = 5061 pacientů. Nežádoucí příhody, které se vyskytují méně často, by obecně nebyly zjištěny na statisticky významné úrovni. Korekcí na četnost nežádoucích příhod náhodně se vyskytujících v kontrolní skupině a normalizací na událost # na 10000 pacientů získáte údaje shrnuté v tabulce.
Všimněte si také, že v případě závažných nežádoucích příhod zvláštního významu, aby se dospělo k hodnotám, které podle jejich odhadů představují statistickou významnost, musely být zkombinovány údaje z klinických studií společnosti Pfizer a Moderna. Něco, co by se v "reálném světě" nikdy neprovádělo, protože oba přípravky jsou odlišné, zahrnují různé formy podání a jsou podávány ve velmi odlišných dávkách mRNA.
Z výše uvedeného můžete ocenit, že tato analýza je v podstatě tak dobrá, jak jen může být, vzhledem k tomu, s čím autoři pracovali. Nyní však také dokážete ocenit, proč (vhodně) stručně informovali o svých zjištěních ("Vše, co chceme, jsou fakta, madam") a poté vyvodili přiměřeně opatrný závěr:
"Nadměrné riziko závažných nežádoucích příhod zjištěné v naší studii poukazuje na potřebu formálních analýz škod a přínosů, zejména takových, které by byly stratifikovány podle rizika závažných následků COVID-19, jako je hospitalizace nebo úmrtí."
Jednalo se o heroické společné úsilí, které se snažilo vrátit do bodu historie klinického výzkumu těchto mRNA vakcín, kdy byla učiněna zásadní rozhodnutí, která doslova ovlivní běh dějin. Tehdejší rozhodnutí byla uspěchaná, užitečnost obou studií byla zničena (záměrně?) předčasným zastavením studií a následným očkováním kontrolní skupiny a to, jaké údaje byly shromážděny, bylo z velké části skryto před těmi, kteří chtějí provést nezávislé analýzy. Autoři současného pokusu o opakování analýzy udělali, co bylo v jejich silách. Jak však Dr. Doshi a jeho kolegové opakovaně požadovali, řádnou analýzu nelze provést, pokud nebudou zveřejněny původní soubory dat.
Do té doby budeme mít vždy Paříž. Tady se na tebe díváme, chlapče. Zahraj to znovu, Same. Zahraj "Jak jde čas".