Miesto štiepenia furínu: Jadrový lokalizačný signál premiestňuje hrot a jeho mRNA do jadra, vyvoláva ukladanie histónu H3.3 a rýchle starnutie
Prečo je štiepne miesto furínu, ktoré sa nenachádza v iných kornavírusoch, oveľa, oveľa viac (a nebezpečnejšie) ako len štiepne miesto.
WALTER M CHESNUT, 11. apríla 2023
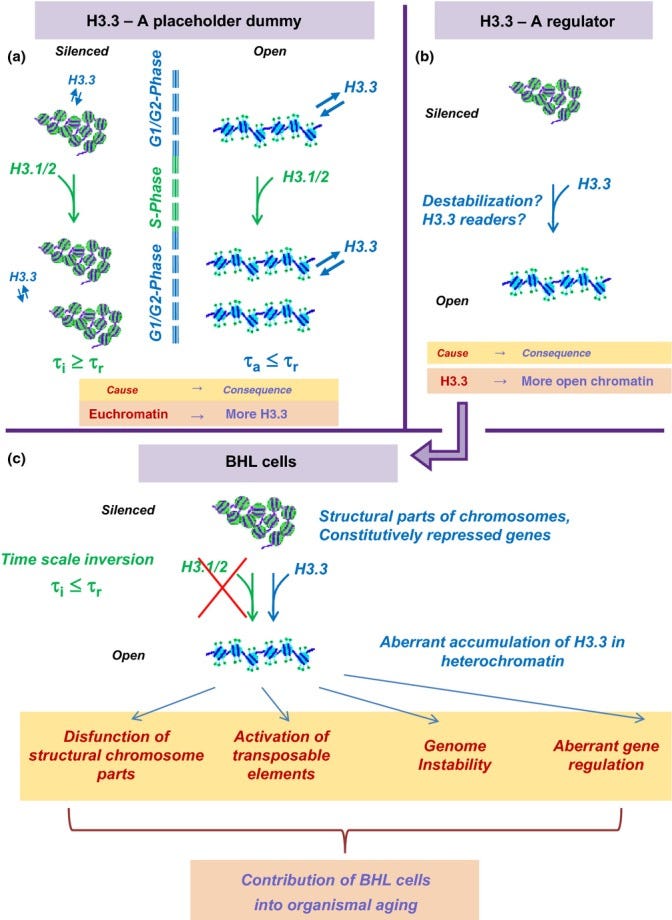
Dilema H3.3. Vrchol. Alternatívne vysvetlenia asociácie H3.3 s aktívnym chromatínom. (a) Zástupná figurína. Euchromatín (vpravo) je otvorenejší a náchylnejší na poškodenie a výmenu histónov ako heterochromatín (vľavo). Čas obratu histónov H3 v aktívnom chromatíne τa je kratší ako čas bunkovej replikácie τr. V súlade s tým replikáciou podmienené ukladanie kanonického H3.1/2 nemôže byť zodpovedné za obrat všetkých histónov H3, čo by malo viesť k prednostnej akumulácii H3.3 v otvorenom chromatíne. Naopak, rýchlosť obratu H3 v heterochromatíne τi je pomalšia ako τr a replikačne viazané ukladanie H3.1/2 môže byť dostatočné na výmenu H3. (b) Regulátor. Chromatín obsahujúci H3.3 je v určitom ohľade "špeciálny" a nahradenie H3.3 kanonickým H3.1/2 vedie k otvoreniu chromatínu alebo k iným dôsledkom pre jeho štruktúru a funkciu. Dole. Dôsledky modelu "regulátora" v prípade buniek pod Hayflickovou hranicou (BHL). Očakáva sa, že čas replikácie BHL buniek bude pomalší ako rýchlosť výmeny H3 v heterochromatíne, čo by malo viesť k akumulácii histónov H3.3 v heterochromatíne BHL buniek s potenciálne negatívnymi dôsledkami z hľadiska štruktúry a funkcie.
Dnes už neslávne známe štiepne miesto furínu v proteíne hrotu SARS-CoV-2 je oveľa viac ako len štiepne miesto. Toto štiepne miesto je zároveň jadrovým lokalizačným signálom (NLS). Dáva pokyn bunke, aby sa transportovala do jadra bunky. Tam, ako ukážem, potom indukuje ukladanie histónu H3.3, čo vedie k rýchlemu starnutiu organizmu, čím sa vysvetľuje obrovské množstvo ochorení súvisiacich s vekom, ktoré pozorujeme po infekcii COVIDom a vystavení spike proteínu.
Dňa 27. septembra 2022 bola publikovaná práca, ktorá potvrdila, že proteín Spike a jeho mRNA sa premiestňuje do jadra bunky. Tam ukážem, ako takmer určite vyvoláva ukladanie histónu H3.3 do chromatínu, čo spôsobuje rýchle starnutie organizmu.
Na záver možno konštatovať, že proteín S vírusu SARS-CoV-2 má funkčný pat7 NLS "PRRARSV", ktorý spôsobuje, že jeden zo štyroch proteínov S sa v infikovaných bunkách premiestňuje do jadra. Zdá sa, že S proteín prenáša do jadra aj S mRNA (možno aj genóm). NLS proteínu S teda môže prispievať k vyhýbaniu sa imunitnej odpovedi hostiteľa a je novou patogénnou vlastnosťou SARS-CoV-2.
Jadrová translokácia mRNA a proteínu hrotu je novým patogénnym znakom SARS-CoV-2
https://www.biorxiv.org/content/10.1101/2022.09.27.509633v1.full
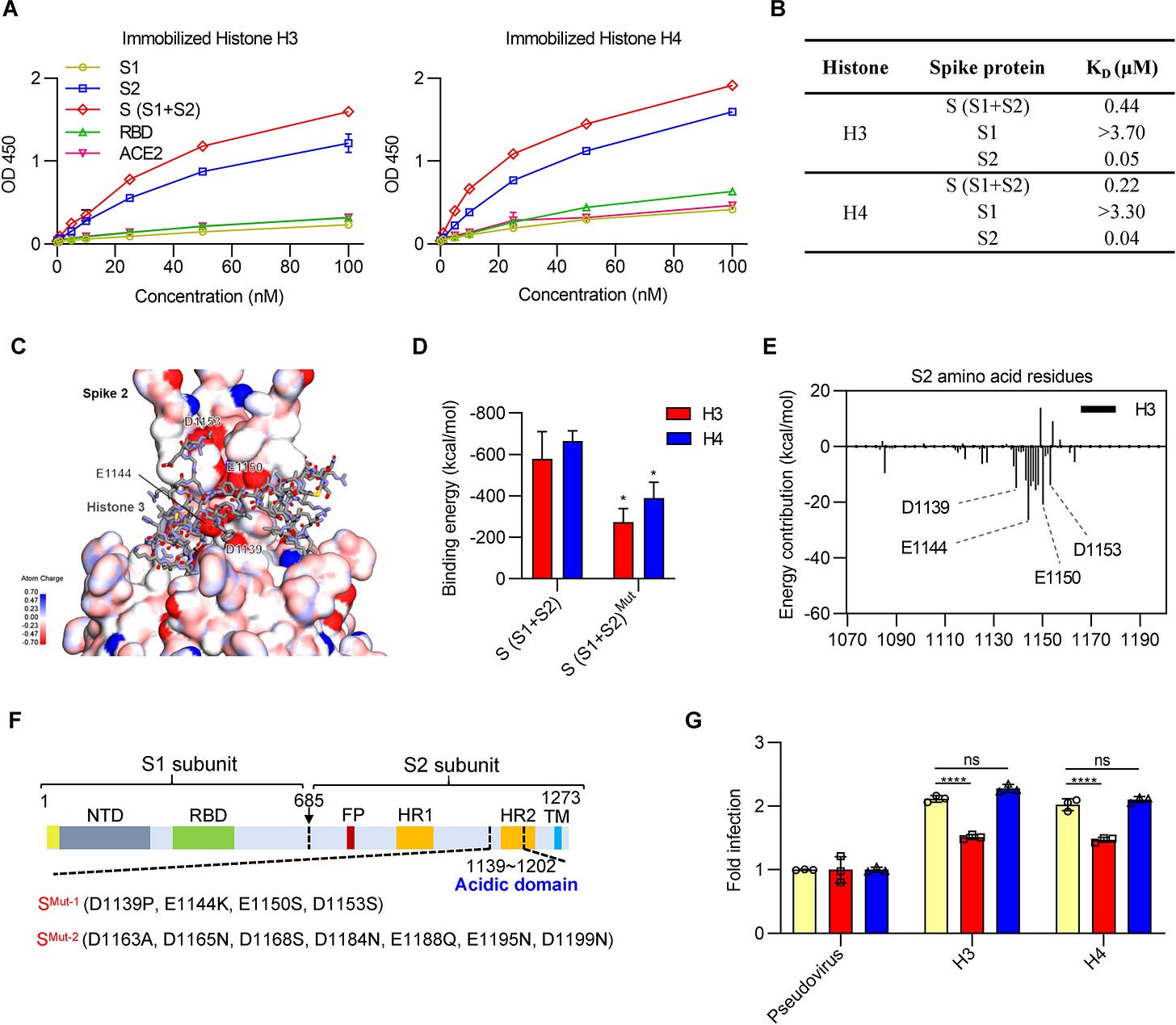
V článku sa však nehovorí o tom, že keď sa proteín Spike premiestni do jadra, podjednotka S2 interaguje s histónom H3.
Domnievam sa, že dochádza k tomu, že interakcia jednotky S2 s histónom H3 spolu s indukciou reakcie na tepelný šok proteínom Spike vyvoláva ukladanie H3.3. To má potom pre hostiteľa katastrofálne následky – najmä pokiaľ ide o starnutie a choroby súvisiace s vekom. Zdá sa, že organizmus vníma útok podjednotky S2 na histón H3 ako odstránenie alebo rozloženie histónu, a preto vyvolá náhradný H3.3.
Uloženie variantných histónov si vyžaduje odstránenie alebo rozobratie existujúcich nukleozómov.
Použitie označených variantov nám umožnilo sledovať množstvo nukleozómov špecifických variantov H3 počas a po dočasnej indukcii génu reagujúceho na tepelný šok (HSP70).
Variant histónu H3.3 sa ukladá v miestach nukleozómového posunu v celom transkribovanom géne, zatiaľ čo aktívne modifikácie histónu vykazujú promótorovú proximálnu tendenciu
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1182337/
Druhý, Hsp70, sa podieľa na rozpoznávaní SARS-CoV-2 hostiteľskou bunkou a na vstupe vírusu. Od úsvitu COVID-19 prvé štúdie ukázali, že GRP78 je nadmerne exprimovaný v endoplazmatickom retikule (ER) určenom pre bunkovú membránu. Prediktívne aj štrukturálne štúdie ukázali, že GRP78 pomáha pri rozpoznávaní hrotov SARS-CoV-2 hostiteľskou bunkou. Predpokladá sa, že väzba Grp78 na oblasť C480-C488 (CNGVEGFNC) na C-konci S1 (hrot) prebieha prostredníctvom vodíkových a hydrofóbnych interakcií.
Zachytávanie zdrojov hostiteľskej bunky: Úloha proteínov tepelného šoku a polyamínov v ceste SARS-COV-2 (COVID-19) k vírusovej infekcii
https://www.degruyter.com/document/doi/10.1515/bmc-2022-0008/html?lang=en
Teraz sa dostávame k podstate. Furínové štiepne miesto tým, že v konečnom dôsledku vyvoláva ukladanie H3.3, má mimoriadne patologické účinky na hostiteľa.
Uvažujme teraz, že spojenie H3.3 s aktívnym chromatínom je spôsobené jeho úlohou pri vytváraní aktívneho a otvoreného stavu chromatínu. V tomto prípade by sa dalo očakávať, že jeho inkorporácia do heterochromatínu by mohla nežiaducim spôsobom ovplyvniť bunky BHL. Umlčovanie založené na heterochromatíne je základným mechanizmom, ktorý sa používa na obmedzenie expresie génov na gény pre udržiavanie poriadku a gény špecifické pre jednotlivé línie, ako aj na potlačenie parazitických sebeckých prvkov (napr. transpozónov). Repetitívne sekvencie so štrukturálnou úlohou (napr. satelitná DNA) musia byť tiež transkripčne umlčané. Možno si predstaviť, ako by otvorenie inak umlčaného chromatínu v nevhodných kontextoch viedlo k nežiaducej transkripčnej aktivácii (alebo inak ku konkurencii s inými genomickými miestami o väzbu dostupných transkripčných faktorov) s negatívnymi dôsledkami v dôsledku narušených epigenetických programov a vyvolania nestability genómu (prostredníctvom aktivácie transpozibilných elementov a/alebo ovplyvnenia štrukturálnych častí chromozómov).
Biologická úloha H3.3 je v poslednom čase predmetom intenzívneho výskumu. K naliehavosti tohto úsilia prispieva čoraz viac dôkazov, že H3.3 a jeho šaperóny sa podieľajú na vzniku rakoviny (Schwartzentruber et al., 2012; Behjati et al., 2013; Fontebasso et al., 2013; Aihara et al., 2014; Venneti et al., 2014).
Úvahy o dileme H3.3 sa teda týkajú biológie dospelých SC, najmä počas ich nereplikujúceho sa štádia, aj keď sú málo ovplyvnené Hayflickovým limitom. Napriek mnohým technickým problémom pri izolácii a práci s neaktívnymi dospelými SC by mal budúci výskum objasniť, ako by akumulácia H3.3 v heterochromatíne mohla ovplyvniť ich hlavné vlastnosti: schopnosť sebaobnovy a diferenciácie, čo má priamy význam pre starnutie organizmu.
Ešte dôležitejšie je, že zmeny v profiloch génovej expresie spôsobené nesprávnou inkorporáciou H3.3 môžu pomôcť vysvetliť, ako bunkové starnutie prispieva k starnutiu organizmu – spôsobmi, ktoré prichádzajú okrem samotnej straty proliferačného potenciálu a obmedzenej regenerácie tkaniva. Jedným zo znakov bunkovej senescencie je sekrečný fenotyp spojený so senescenciou (SASP), ktorý má za následok vylučovanie rôznych rastových faktorov, cytokínov a proteáz (nazývaných súhrnne senescence messaging secretome (sekrét oznamovania senescencie – SMS) (Kuilman & Peeper, 2009)), čo vedie k dysfunkcii a narušeniu tkanív súvisiacich s vekom (Coppe et al., 2008; Rodier & Campisi, 2011).
Nesprávna akumulácia H3.3 v heterochromatíne by mohla aktivovať inak umlčané gény a synergicky pôsobiť s negatívnym účinkom neopravených lézií DNA, ktoré sa v ňom hromadia. Toto je ďalší aspekt dilemy H3.3, ktorý čaká na ďalšie skúmanie.
Molekulárny obrat, dilema H3.3 a starnutie organizmu (hypotéza)
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4406661/
To dokazuje, že miesto štiepenia furínu veľmi šikovným spôsobom v skutočnosti nefunguje ani tak na štiepenie hrotu, ale na jeho privedenie do jadra. Tam funguje azda najsilnejším spôsobom na vyvolanie rýchleho starnutia hostiteľa.