Ivermektín znižuje rezistenciu rakovinových buniek voči liekom prostredníctvom dráhy EGFR/NFkB
Justus R. Hope, 19. augusta 2024
Štúdia z roku 2019 poukazuje na prínosy liečby rakoviny Ivermektínom (IVM)
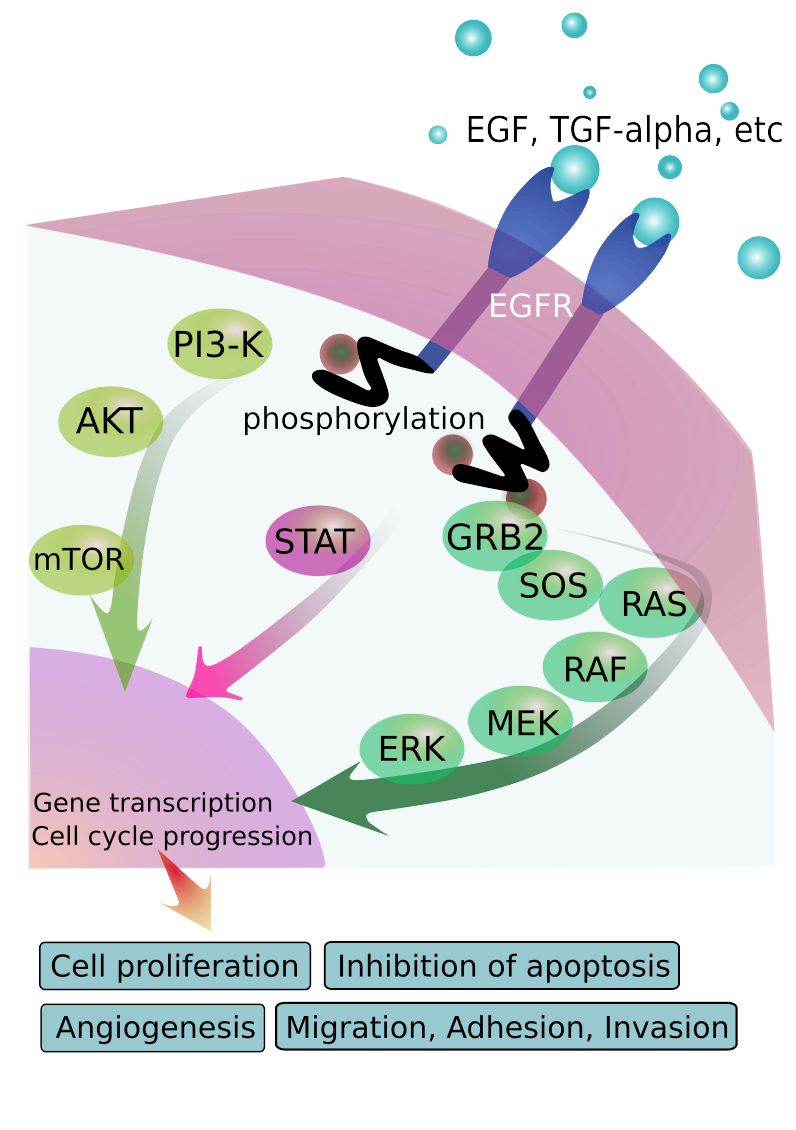
EGFR - receptor epidermálneho rastového faktora - je hnacou silou rezistentných rakovín pľúc, mozgu, prsníka a prostaty
V júni 2019, oveľa skôr, ako ktokoľvek počul o nejakom COVIDe-19, čínska skupina výskumníkov písala o masívnych protirakovinových prínosoch ivermektínu, lieku, ktorý sa v tom čase tešil nepoškvrnenej povesti bezpečnosti a vynikajúcej kvality pri liečbe parazitárnych ochorení. Okrem toho by sa IVM mohol opätovne použiť aj pri liečbe rakoviny.
Tento tím bystro zistil, že Ivermektín by mohol obnoviť citlivosť v prípadoch rakoviny rezistentnej na chemoterapiu .
Prečo je to dôležité?
Pretože 90% úmrtí na rakovinu súvisí s rezistenciou na lieky.
Ak by sme dokázali poraziť rezistenciu na lieky, dokázali by sme poraziť aj rakovinu. Ak by sme dokázali dôsledne obnoviť citlivosť rakoviny na lieky pridaním preklasifikovaného lieku, akým je ivermektín, mohli by sme zmeniť svet.
Dr. Lu Jiang a jeho kolegovia ako prví dokázali, že Ivermektín dokáže znížiť alebo odstrániť rezistenciu na viaceré lieky pri liečbe rakoviny in vivo – teda v živom organizme. Hoci mnohé štúdie môžu preukázať účinok proti rakovinovým bunkám v skúmavke alebo in vitro, oveľa významnejšie je preukázať prínos u človeka alebo živého zvieraťa.
Výskumný tím zistil, že ivermektín by mohol účinne zvrátiť rezistenciu voči chemoterapeutickým liekom, konkrétne blokovaním dráhy EGFR, čo by mohlo zlepšiť výsledky liečby rakoviny.
Najprv si zopakujme, prečo je taká dôležitá kontrola EGF – epidermálneho rastového faktora, ak chceme liečiť rakovinu. EGF a jeho receptor EGFR výrazne podporujú metastázovanie a šírenie rakoviny.
„Popri udržiavaní proliferácie buniek a poskytovaní rezistencie voči protinádorovým cytotoxickým liekom EGFR silne podporuje metastázovanie prostredníctvom veľkého súboru parakrinných slučiek, z ktorých každá kontroluje kritický krok kaskády metastázovania. V posledných rokoch sme sa dozvedeli, že rôzne nekódujúce RNA vrátane mikroRNA a kruhových RNA zohrávajú v signalizácii EGFR nečakane komplexné regulačné funkcie.“
V tejto štúdii PubMed sa uvádza , že dráha EGFR sa výrazne podieľa na tvorbe metastáz a môže byť spustená viacerými epigenetickými faktormi vrátane mikroRNA.
Ako stručný prehľad, epigenetika zahŕňa to, ako správanie a prostredie môžu zmeniť spôsob, akým gény fungujú, ich „zapínanie“ a „vypínanie“. Dr. Peter McCullough nedávno v rozhovore hovoril o epigenetike. Okrem toho, že epigenetika zabraňuje vzniku chorôb alebo ich spôsobuje, môže pomôcť človeku vyzerať mladšie alebo staršie, ako je jeho biologický vek.
Dr. McCullough uviedol, že v priebehu ôsmich rokov absolvoval maratón v každom z 50 štátov USA. Potom položil otázku, či cvičenie v niektorých prípadoch nemôže byť také intenzívne, že skôr podporuje starnutie, ako ho znižuje. A odpoveď znie áno [25:30]. Presne tomuto bodu som sa venoval vo svojej knihe Kávová kúra 2019.
Môže epigenetika ovplyvniť starnutie?
Prirodzene, človek môže mať prospech z priaznivejšej epigenetiky prostredníctvom pozitívnych vplyvov životného štýlu a prostredia, alebo naopak nepriaznivejších prostredníctvom opačných vplyvov. Spomeňte si na priaznivé voľby chôdze hodinu denne počas dvadsiatich rokov oproti fajčeniu 2 krabičiek denne počas desiatich rokov. Negatívne epigenetické účinky niektorých nedávnych injekcií na zdravie však vychádzajú na povrch až teraz.
Už dlho je známe, že epigenetické modifikácie DNA spôsobujú rakovinu. Tri hlavné mechanizmy epigenetických modifikácií sú
nekódujúce RNA
modifikácia histónov
metylácia DNA
Dr. William Makis písal o mikroRNA spojených s mRNA vakcínami, ktoré považuje za onkogénne. Makis a ďalší autori písali o nedávnom vzniku turbo rakoviny [10:21].
Je známe, že cirkulárna RNA, nekódujúca RNA a mikroRNA sú epigeneticky spojené s rakovinou prostredníctvom ich vplyvu na EGF a EGFR.
Jiang a jeho kolegovia písali o protinádorových účinkoch Ivermektínu pri zvrátení rezistencie na chemoterapeutiká prostredníctvom cesty EGFR. Ukázali, že Ivermektín sa priamo viaže na EGFR a obnovuje citlivosť na chemoterapiu.
Autori uviedli, že rezistencia na lieky EGFR zohráva významnú úlohu pri rakovine prsníka a prostaty. Jej zvrátenie tak môže zmeniť situáciu.
Stupeň tejto zmeny pri IVM bol pozoruhodný. Jiang a jeho kolegovia sa vo svojej štúdii zaoberali kolorektálnym karcinómom rezistentným na vinkristín, karcinómom prsníka rezistentným na adriamycín a napokon chronickou myeloidnou leukémiou rezistentnou na adriamycín. Tieto druhy rakoviny si vybrali preto, lebo kolorektálny karcinóm a prsník patria medzi najčastejšie solídne zhubné nádory a chronická myeloidná leukémia je jedným z najčastejších zhubných nádorov krvi.
Pridanie ivermektínu zvýšilo citlivosť adriamycínu v rezistentných nádorových bunkách 49-násobne.
Vedci vo svojej štúdii použili u myší dávku 2,0 mg/kg a poznamenávajú, že to zodpovedá dávke, ktorá sa predpisuje väčšine ľudí na parazity. S úctou dodávam, že podľa mojich skúseností je štandardná dávka Ivermektínu pre ľudí napríklad na svrab bližšie k 0,2 mg/kg.
„V našej štúdii sa však po prvýkrát ukázalo, že IVM by mohol zvrátiť viacnásobnú liekovú rezistenciu rakovinových buniek in vivo. Navyše dávka (2 mg/kg telesnej hmotnosti, i.p.), ktorú sme použili u myší, bola nižšia ako tie, ktoré sa používajú na priamu inhibíciu rastu nádorov. Okrem toho sa ukázalo, že dávka 2 mg/kg približne zodpovedá dávke, ktorá sa podáva ako anthelmintikum u ľudí [17, 41].“
Význam EGFR pri spúšťaní a udržiavaní rastu rakoviny nemožno preceňovať. EGFR je základným členom viacerých receptorov rastových faktorov so spoločným mechanizmom – tyrozínkinázou. Medzi ďalšie patrí jeho preferovaný heterodimér HER2/ERBB2, ktorý je spoločný pre rakovinu prsníka. Množstvo EGFR a príbuzných mutácií sa vyskytuje v nádoroch mozgu a pľúc.
Preto bolo vyvinutých mnoho liekov - inhibítorov tyrozínkinázy - zameraných na EGFR. Medzi tieto TKI patria lapatinib a sorafenib. TKI – hoci sa často označujú za zázračnú guľku – takmer vždy postihne rovnaký osud, a to rýchly rozvoj liekovej rezistencie.
„Napriek dostupnosti viacerých TKI špecifických pre EGFR je teda dlhodobá účinnosť týchto liekov obmedzená viacerými cestami získanej rezistencie.“
Nedávna štúdia preukázala, že ivermektín pôsobí synergicky proti hepatocelulárnemu karcinómu v kombinácii so sorafenibom, inhibítorom kináz.
Ivermektín má však protinádorovú aktivitu ďaleko za hranicou svojho účinku na EGFR a príbuzné lieky. Pri karcinóme pankreasu môže synergicky zvyšovať účinnosť Gemcitabínu svojím pôsobením na mTOR a STAT a na mitochondrie.
Pri každom výskume Ivermektínu na preformulovanie existujúcich liekov proti rakovine sa vždy radím so svetovou autoritou v tejto oblasti, Dr. Paulom Marikom, a najmä s jeho knihou Cancer Care. Konzultoval som s s ním IVM a cieľových rakovinách, mechanizmoch účinku, dávkovaní a upozorneniach.
Dr. Marik uvádza, že Ivermektín preukázal in vitro aktivitu proti všetkým nasledujúcim druhom rakoviny – rakovine prsníka (vrátane TNBC), ako aj rakovine pľúc, žalúdka, krčka maternice, pažeráka, endometria, pečene, prostaty, obličiek a vaječníkov, ako aj cholangiokarcinómu, melanómu, leukémie, lymfómu a gliómov.
Dr. Marik tiež upozornil na štúdiu, ktorá ukázala, že ivermektín znižuje rezistenciu na lieky prostredníctvom svojho účinku na glykoproteín P. To sa zhoduje so štúdiou Jianga, ktorá ukázala, že Ivermektín pôsobí prostredníctvom dráhy EGFR/ ERK/ Akt/ NfkB, ktorá v konečnom dôsledku „znižuje expresiu P-gp“.
Marik poznamenáva, že existuje viacero mechanizmov protirakovinového účinku ivermektínu vrátane využitia dráhy Akt/mTOR na indukciu autofágie, indukcie apoptózy prostredníctvom mitochondrií a inhibície dráhy WNT.
Dr. Marik hovorí o optimálnej dávke ivermektínu pre jeho protirakovinové účinky. Píše, že účinných môže byť 12 až 18 mg denne predpísaných na dobu neurčitú. Podľa môjho názoru pri metastatickom ochorení môžu byť potrebné vyššie dávky;
až 10-násobne vyššie pri dávke 2,0 mg/kg/deň, ak máme skúmať prácu Dr. Landrita.
Ivermektín má však mimoriadne bezpečné výsledky.
V nedávnom článku uverejnenom v Desert Review Dr. Landrito informoval o úspešnej liečbe rakoviny 4. štádia pomocou vyšších dávok IVM, dávok presahujúcich 100 až 150 mg denne.
Dr. Marik upozorňuje, že v prípadoch poškodenia hematoencefalickej bariéry je potrebná zvýšená opatrnosť pri dávkovaní.
S tým, že Dr. Landrito vysvetľuje, že nezaznamenal žiadne nežiaduce účinky Ivermektínu, dokonca ani pri narušení hematoencefalickej bariéry, a používa Ivermektín v prípadoch glioblastómu [48:28].