Ivermektín môže poraziť rakovinu a iné bežné chronické ochorenia súvisiace so starnutím
Ak si myslíte, že Big Pharma mala dobré dôvody na cenzúru ivermektínu počas C19, čo teraz, keď vieme, že je pravdepodobne účinný proti všetkým chronickým chorobám spojeným so starnutím?
DR. MARIAN LADEROUTE, 15. júna 2023
Dr. Paul Marik nedávno citoval prospektívnu klinickú štúdiu, v ktorej účastníci dostali 4,000 medzinárodných jednotiek vitamínu D, omega 3 a povedali im, aby cvičili – a riziko rakoviny kleslo o 50 %.
V inom príspevku Dr. Marik hovorí, že je veľmi nepravdepodobné, že by rakovina bola geneticky podmienená.
V tomto príspevku chcem hovoriť o oboch. V júli 1994 som v časopise Molecular Carcinogenesis uverejnila novú teóriu rakoviny, z ktorej vyplýva, že nádory sú síce geneticky podmienené, ale zhubná povaha nádorov (t.j. to, čo nazývame rakovinou) nie [1].
Táto predstava, že malignita je fenotyp, a nie genotyp, bola v tom čase kacírska, a tak bol článok odignorovaný (nadšení boli len redaktori Molecular Carcinogenesis a ja). Bola to vzrušujúca myšlienka, pretože znamenala, že sa dá farmakologicky kontrolovať malígny potenciál nádorov. Už nebolo potrebné žiadne rezanie a vypaľovanie, ktoré som vždy považovala za barbarské.
Následne sa však začalo všeobecne akceptovať, že malígny fenotyp rakoviny nazývaný "epiteliálno-mezenchymálny prechod" (EMT) je skutočný [2]. Takže som bola akoby ospravedlnená, hoci sa zdá, že si to okrem mňa nikto nevšimol.
Dôvod, prečo som navrhla rakovinu ako fenotyp, bol ten, že som práve dokončil charakterizáciu 67 kD receptora alfa-fetoproteínu (AFP) pre svoju doktorandskú prácu [3–6]. Receptor AFP (AFPr) [4] bol exprimovaný na makrofágoch [3,6] a vysoko nadmerne exprimovaný na bežných nádorových ochoreniach adenokarcinómoch (prsníka, prostaty, pľúc, hrubého čreva atď.) [3,5], čo naznačuje dvojitú úlohu v imunosupresii hostiteľa a v malígnom potenciáli nádoru. V skutočnosti som napísala teóriu, aby som vysvetlila, ako imunosupresia hostiteľa súvisí s malígnym potenciálom nádoru.
AFP bol vôbec prvým opísaným imunosupresívnym faktorom (1974) a prvým objaveným nádorovým markerom (1963). Ako prví sme v roku 1994 ukázali, že zabraňuje lýze (apoptóze) buniek makrofágov [6].
V súčasnosti je dobre známe, že AFP prispieva k malígnemu fenotypu prostredníctvom dráhy PI3K/Akt/mTOR, tej istej, ktorú poskytuje HER-2/neu (ERBB2) podporujúci malignitu.
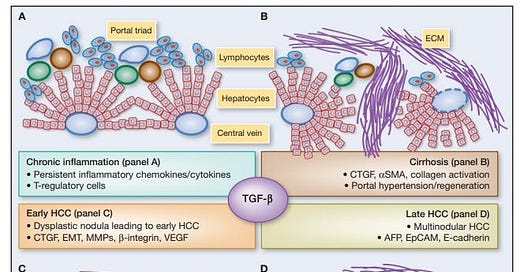
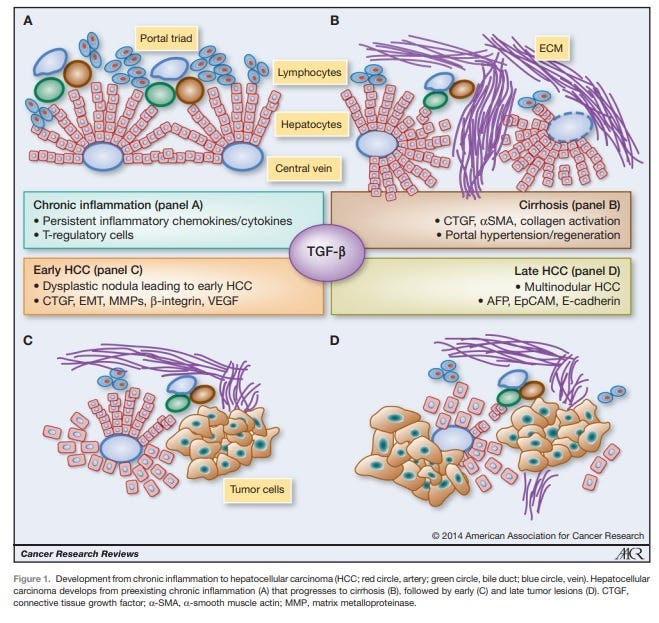
Obr. 1: Z Giannelli G et al, Cancer Research 2014 [7]. AFP je uznávaný ako faktor progresie malignity pri veľmi rozšírenom nádorovom ochorení vo svete, hepatocelulárnom karcinóme (HCC), ktorý sa často spája s vírusovým pôvodom
Malígny potenciál nádorov známych ako rakovina bol teda prístupný farmakologickému zásahu a subjektom, ktoré inaktivujú AFP.
AFP existuje v aktívnom a neaktívnom stave. Veci, ktoré sa viažu na AFP a inaktivujú ho (zinok, DHEA, flavonoidy atď.), sú entity, ktoré môžu pomôcť podporiť vrodenú imunitu (makrofágov) a ktoré tiež znižujú malígny potenciál nádorov.
V tom čase som tento malígny fenotyp nádorov nazvala "protibunková senescencia" [1]. Bolo to preto, že nádor bol refraktérny voči novým signálom, keďže väzba AFP na AFPr na nádoroch blokovala prichádzajúce signály. Zdalo sa teda, že nádor sa nemení ani nestarne, pretože nemôže reagovať na bunkové signály. {Všimnite si, že anti-aging na bunkovej úrovni je spojený so starnutím na úrovni celého hostiteľa.}
Hoci sa malígny fenotyp v súčasnosti uznáva ako "epitelovo-mezenchymálny prechod" (EMT), našťastie Dr. Robert Weinberg zahrnul fenotyp blokovania starnutia ako významný pre EMT [8], t.j. EMT je fenotyp zahŕňajúci antibunkové starnutie (fíha!).
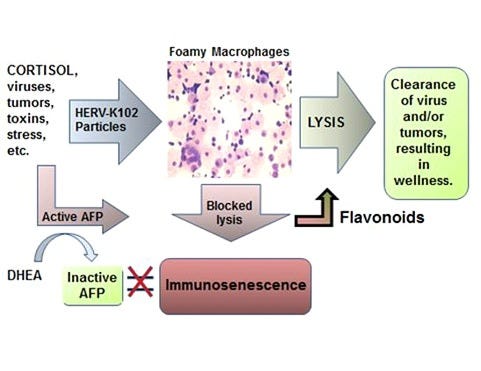
Potom som v roku 2015 napísala novú paradigmu imunosenescencie makrofágov uverejnenú v časopise Discovery Medicine (obrázok 2), ktorá sa snaží vysvetliť príčinu chronických ochorení spojených so starnutím vrátane chorôb, ako sú rakovina a kardiovaskulárne ochorenia [9].
Za zmienku stojí, že imunosenescencia makrofágov zahŕňa imunosupresiu A paradoxne nekontrolované uvoľňovanie prozápalových faktorov, ako sú IL-6, TNF-alfa a IL-1beta. Práve zápal prispieva k vzniku chronických ochorení. V dôsledku imunosupresie by ho mohli zhoršiť prebiehajúce infekcie.
AFP tým, že viaže 67 kD AFPr na penovité makrofágy (podobné M1), vyvoláva imunosupresiu a zabraňuje down-modulácii zápalových faktorov. Predpokladá sa, že zápal prebieha prostredníctvom aktivácie NFKB1 (pozri neskôr). Imunosenescencia makrofágov teda zahŕňa imunosupresiu a súčasné uvoľňovanie prozápalových faktorov (tie sa nedajú downregulovať).
Obr. 2: Nová paradigma imunosenescencie makrofágov
bola definovaná ako neúspešné (lytické) uvoľňovanie protektorových častíc HERV-K102 z penových makrofágov. HERV-K102 je nepatogénny, protektívny penový retrovírus, ktorý je jedinečný pre ľudí a spôsobuje, že makrofágy sú penové (častice sa hromadia vo vakuolách v cytoplazme a dodávajú bunkám penový vzhľad). Ak je pomer DHEA /kortizol nízky, existuje vyššie riziko imunosenescencie pri vystavení vírusu v dôsledku nedostatočnej hladiny DHEA na naviazanie a inaktiváciu AFP. V roku 1994 sme uviedli, že AFP blokuje apoptózu makrofágov [6]. Neúspešné lytické uvoľňovanie protektorových častíc HERV-K102 je teda spôsobené AFP. AFP teda spôsobuje imunosenescenciu makrofágov
Následne som túto paradigmu overila špeciálne na vysvetlenie vzniku a progresie kardiovaskulárnych ochorení (KVO) [10]. Všimnite si, že vysoký cholesterol nevyvoláva aterosklerózu ani KVO. Je teda mylné tvrdenie, že znižovanie cholesterolu, napríklad pomocou statínov, znižuje kardiovaskulárne riziká. Statíny však zabraňujú aktivácii makrofágov, aby sa stali penovitými tým, že blokujú cholesterolovú (mevalonátovú) dráhu, a tá blokuje KRITICKÚ trénovanú (vrodenú) imunitu [11,12].
Používanie STATÍNOV NIE JE veľmi múdrou voľbou (keďže blokujú KRITICKÚ vrodenú imunitu) počas pandémie alebo pri boji s rakovinou, najmä s rakovinou turbo!
Stres a infekcie spôsobujú aktiváciu makrofágov, ktoré sa stávajú penovitými. Keď sa totiž makrofágy stanú penovitými, exprimujú ACE (nie ACE2), ktorý zvyšuje krvný tlak. Po 7 dňoch, keď spenené makrofágy prejdú apoptózou (lýzou buniek), aby sa uvoľnil protektor HERV-K102, sa krvný tlak vráti do normálu (už žiadne spenené makrofágy neexprimujú ACE, takže už žiadny zvýšený krvný tlak).
Na druhej strane, ak k infekcii dôjde, keď je pomer DHEA /kortizolu nedostatočný (napríklad u nezdravých starších ľudí alebo v strese), na 7. deň sa penovým makrofágom nepodarí uvoľniť častice HERV-K102 a nastane imunosenescencia. Časom sa zvýši krvný tlak. To môže byť dôvod, prečo je hypertenzia veľmi častým rizikovým faktorom pre závažné ochorenie C19, pretože znamená, že vaša KRITICKÁ trénovaná (vrodená) imunita je narušená.
Ako je znázornené na obrázku 2, vakuoly a vysoké hladiny protektorových častíc HERV-K102 vyžadujú vysoké hladiny cholesterolu. Človek teda skutočne potrebuje zachovať cestu cholesterolu počas infekcií.
P53 spolu s TGF-beta potláča expresiu AFP [13] a p53 je nádorový supresor, ktorý sa v nádoroch/rakovinách bežne odstraňuje alebo je aspoň nefunkčný.
ZBTB20 je transkripčný faktor so zinkovým prstom, ktorému sa pripisuje post-natálna downregulácia AFP. Ak však funkčný p53 chýba, zvyšuje reguláciu AFP [14].
Vedeli ste, že ZBTB20 je potrebný na indukciu NFKB1 [15], napríklad keď SARS-CoV-2 infikuje penové makrofágy in vivo prostredníctvom protilátkovo závislého zosilnenia infekcie (ADE) [16], ktoré prispieva k cytokínovej búrke? AFP je výrazne regulovaný infekciou SARS-CoV-2 na úrovni proteínov a mRNA v bunkových líniách [17].
Ak sa vrátime k obrázku 2, antagonisty AFP zvrátia a zabránia imunosenescencii. Imunosenescencia spôsobuje chronické ochorenia súvisiace s vekom [9,10]. To znamená, že antagonisty AFP, ako sú zinok, flavonoidy, DHEA /7-ketoDHEA, vitamín D3 nad 150 nmol/l a teraz aj ivermektín [18], sú pravdepodobne antagonistami AFP, u ktorých sa preto predpokladá zníženie rizika chronických ochorení súvisiacich s vekom vrátane rakoviny, kardiovaskulárnych ochorení, vyššieho rizika infekcií atď.
V súčasnosti sa okrem mnohých správ o tom, ako sa ivermektín správa ako silné antivirotikum, objavujú dôkazy o jeho reverzibilite malígneho fenotypu najmä indukciou apoptózy [19] a blokovaním metastáz [20]. Inými slovami, ivermektín, po ktorom vám nevypadávajú vlasy, by mal byť schopný urobiť všetky malígne nádory benígnymi, pretože rieši príčinu "rakoviny". Barbarská rádioterapia a chemoterapia, transplantácia kostnej drene a podobne už údajne nie sú potrebné.
To isté pravdepodobne platí aj pre väčšinu chronických ochorení spojených so starnutím s výnimkou porúch centrálneho nervového systému (ktoré sú často nezvratné).
Ak si teda myslíte, že vojna proti ivermektínu sa skončila, v skutočnosti sa práve ZAČALA.
preklad: Takumi Azadi –> https://tinyurl.com/yxxk3y9a
Laderoute MP. A new perspective on the nature of the cancer problem: anti-cellular senescence. Mol Carcinog. 1994 Jul;10(3):125-33. doi: 10.1002/mc.2940100303.
Zhang Y, Weinberg RA. Epithelial-to-mesenchymal transition in cancer: complexity and opportunities. Front Med. 2018 Aug;12(4):361-373. doi: 10.1007/s11684-018-0656-6.
Laderoute MP. The Characterization of a Novel, Widespread, PNA-Reactive Tumor Associated Antigen: the Alpha-fetoprotein Receptor/Binding Protein. Ph.D. Thesis. The University of Alberta. Canada 1991, pp 256. https://era.library.ualberta.ca/items/6f548eb6-49a2-456c-b472-41f68976077f.
Moro R, Tamaoki T, Wegmann TG, Longnecker BM, Laderoute M. Monoclonal antibodies directed against a widespread oncofetal antigen: the alpha-fetoprotein receptor. Tumor Biology 1993 14 (2):116-130. Https: //doi.org/10.1159/000217864.
Laderoute M, Willans D, Wegmann T, Longenecker M. The identification, isolation and characterization of a 67 kilodalton, PNA-reactive autoantigen commonly expressed in human adenocarcinomas. Anticancer Res. 1994 May-Jun;14(3B):1233-45.
Laderoute MP, Pilarski LM. The inhibition of apoptosis by alpha-fetoprotein (AFP) and the role of AFP receptors in anti-cellular senescence. Anticancer Res. 1994 Nov-Dec;14(6B):2429-38.
Giannelli G, Villa E, Lahn M. Transforming growth factor-β as a therapeutic target in hepatocellular carcinoma. Cancer Res. 2014 Apr 1;74(7):1890-4. doi: 10.1158/0008-5472.CAN-14-0243.
Weinberg RA. Twisted epithelial-mesenchymal transition blocks senescence. Nat Cell Biol. 2008 Sep;10(9):1021-3. doi: 10.1038/ncb0908-1021.
Laderoute MP. A new paradigm about HERV-K102 particle production and blocked release to explain cortisol mediated immunosenescence and age-associated risk of chronic disease. Discov Med. 2015 Dec;20(112):379-91.
Laderoute M. The paradigm of immunosenescence in atherosclerosis-cardiovascular disease (ASCVD). Discov Med. 2020 Jan-Feb;29(156):41-51.
Bekkering S, Arts RJW, Novakovic B, et al. Metabolic induction of trained immunity through the mevalonate pathway. Cell. 2018 Jan 11;172(1-2):135-146.e9. doi: 10.1016/j.cell.2017.11.025.
Bekkering S, Quintin J, Joosten LA, van der Meer JW, Netea MG, Riksen NP. Oxidized low-density lipoprotein induces long-term proinflammatory cytokine production and foam cell formation via epigenetic reprogramming of monocytes. Arterioscler Thromb Vasc Biol. 2014 Aug;34(8):1731-8. doi:
Wilkinson DS, Ogden SK, Stratton SA, Piechan JL, Nguyen TT, Smulian GA, Barton MC. A direct intersection between p53 and transforming growth factor beta pathways targets chromatin modification and transcription repression of the alpha-fetoprotein gene. Mol Cell Biol. 2005 Feb;25(3):1200-12. doi: 10.1128/MCB.25.3.1200-1212.2005.
To JC, Chiu AP, Tschida BR, Lo LH, Chiu CH, Li XX, Kuka TP, Linden MA, Amin K, Chan WC, Bell JB, Moriarity BS, Largaespada DA, Keng VW. ZBTB20 regulates WNT/CTNNB1 signalling pathway by suppressing PPARG during hepatocellular carcinoma tumourigenesis. JHEP Rep. 2020 Dec 19;3(2):100223. doi: 10.1016/j.jhepr.2020.100223.
Liu X, Zhang P, Bao Y, Han Y, Wang Y, Zhang Q, Zhan Z, Meng J, Li Y, Li N, Zhang WJ, Cao X. Zinc finger protein ZBTB20 promotes Toll-like receptor-triggered innate immune responses by repressing IκBα gene transcription. Proc Natl Acad Sci U S A. 2013 Jul 2;110(27):11097-102. doi: 10.1073/pnas.1301257110.
Ren X, Wen W, Fan X, et al. COVID-19 immune features revealed by a large-scale single-cell transcriptome atlas. Cell. 2021 Apr 1;184(7):1895-1913.e19. doi: 10.1016/j.cell.2021.01.053.
Appelberg S, Gupta S, Svensson Akusjärvi S, et al. Dysregulation in Akt/mTOR/HIF-1 signaling identified by proteo-transcriptomics of SARS-CoV-2 infected cells. Emerg Microbes Infect. 2020 Dec;9(1):1748-1760. doi: 10.1080/22221751.2020.1799723. (& personal communication).
Laderoute M. Ivermectin may prevent and reverse immunosenescence by antagonizing alpha-fetoprotein and downmodulating PI3K/Akt/mTOR hyperactivity. Open Heart. April 29, 2021. https://openheart.bmj.com/content/8/1/e001655.responses#ivermectin-may-prevent-and-reverse-immunosenescence-by-antagonizing-alpha-fetoprotein-and-downmodulating-pi3k-akt-mtor-hyperactivity.
Tang M, Hu X, Wang Y, Yao X, Zhang W, Yu C, Cheng F, Li J, Fang Q. Ivermectin, a potential anticancer drug derived from an antiparasitic drug. Pharmacol Res. 2021 Jan;163:105207. doi: 10.1016/j.phrs.2020.105207.
Jiang L, Sun YJ, Song XH, Sun YY, Yang WY, Li J, Wu YJ. Ivermectin inhibits tumor metastasis by regulating the Wnt/β-catenin/integrin β1/FAK signaling pathway. Am J Cancer Res. 2022 Oct 15;12(10):4502-4519.