Bezpečnosť mRNA vakcíny BNT162b2 proti COVIDu-19 v závislosti od šarže
Max Schmeling, Vibeke Manniche, Peter Riis Hansen
Prvé uverejnenie: 30. marca 2023; https://doi.org/10.1111/eci.13998
[Oprava pridaná 13. apríla 2023, po prvom uverejnení online: V tejto verzii bola aktualizovaná afiliácia korešpondujúceho autora]
Editorovi.
Vakcinácia sa široko zaviedla na zmiernenie koronavírusového ochorenia-2019 (Covid-19) a do 11. novembra 2022 bolo v Európskej únii /Európskom hospodárskom priestore (EÚ/EHP) podaných 701 miliónov dávok mRNA vakcíny BNT162b2 (Pfizer-BioNTech), s čím súvisí 971,021 hlásení podozrení na nežiaduce účinky (SAE) (1). Vakcinačné fľaštičky s jednotlivými dávkami sa dodávajú v šaržiach s prísnou kontrolou kvality na zabezpečenie jednotnosti šarží a dávok (2). Klinické údaje o jednotlivých šaržiach vakcín neboli hlásené a zdá sa, že rozdiely v klinickej účinnosti a bezpečnosti autorizovaných vakcín v závislosti od šarže sú veľmi nepravdepodobné. Avšak v neposlednom rade vzhľadom na povolenie núdzového použitia na trhu a rýchlu implementáciu rozsiahlych očkovacích programov sa možnosť odchýlky závislej od šarže javí ako preskúmaniahodná. Preto sme skúmali mieru výskytu SAE medzi rôznymi šaržami vakcíny BNT162b2 podávanými v Dánsku (5,8 milióna obyvateľov) od 27. decembra 2020 do 11. januára 2022.
Údaje o všetkých prípadoch SAE s príslušnými označeniami šarží vakcín nahlásených Dánskej zdravotníckej agentúre (DKMA) a klasifikovaných DKMA podľa závažnosti SAE, resp. počty dávok BNT162b2 v jednotlivých šaržiach vakcín registrovaných Dánskym sérovým inštitútom sú verejne dostupné a boli získané na požiadanie. Systém spontánneho hlásenia SAE spravovaný DKMA prijíma hlásenia SAE z akéhokoľvek zdroja, napríklad od poskytovateľov zdravotnej starostlivosti, pacientov a iných osôb z verejnosti. K SAE sú priradené termíny Lekárskeho slovníka pre regulačné činnosti (MedDRA), ktoré nemusia nevyhnutne zodpovedať overeným lekárskym diagnózam, a k jednému hláseniu môže byť priradených viac ako 1 SAE. Závažnosť SAE bola klasifikovaná ako nezávažná, závažná (hospitalizácia alebo predĺženie existujúcej hospitalizácie, život ohrozujúce ochorenie, trvalé postihnutie alebo vrodená malformácia), resp. smrť súvisiaca so SAE. Štúdia sa opierala výlučne o sekundárne použitie týchto anonymizovaných údajov, a preto bola vyňatá z posudzovania etickou komisiou pre výskum. SAE sa počítali na úrovni šarží prepojením jednotlivých SAE s označením šarže (šarží) dávky (dávok) BNT162b, ktoré subjekt dostal. Celkový počet SAE spojených s každou dávkou sa vydelil počtom dávok v dávke, aby sa získal počet SAE na 1,000 dávok. Keďže pozorovaný vzťah medzi počtom SAE a dávkami vakcíny BNT162b2 bol veľmi heterogénny, konvenčná regresná štatistika sa nepovažovala za použiteľnú. Preto sa heterogenita vo vzťahu medzi počtom SAE a dávkami na šaržu vakcíny posudzovala logaritmickou transformáciou, po ktorej nasledovala nehierarchická zhluková analýza a test všeobecného lineárneho modelu (GLM) na rozdiely v počte SAE medzi šaržami. Podávanie správ o štúdii je v súlade so všeobecnými usmerneniami EQUATOR (3).
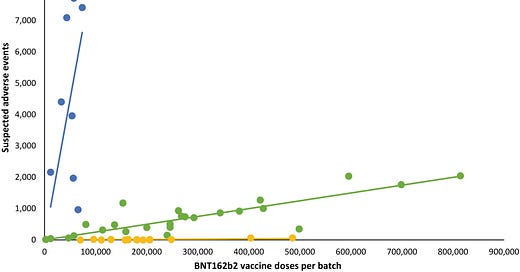
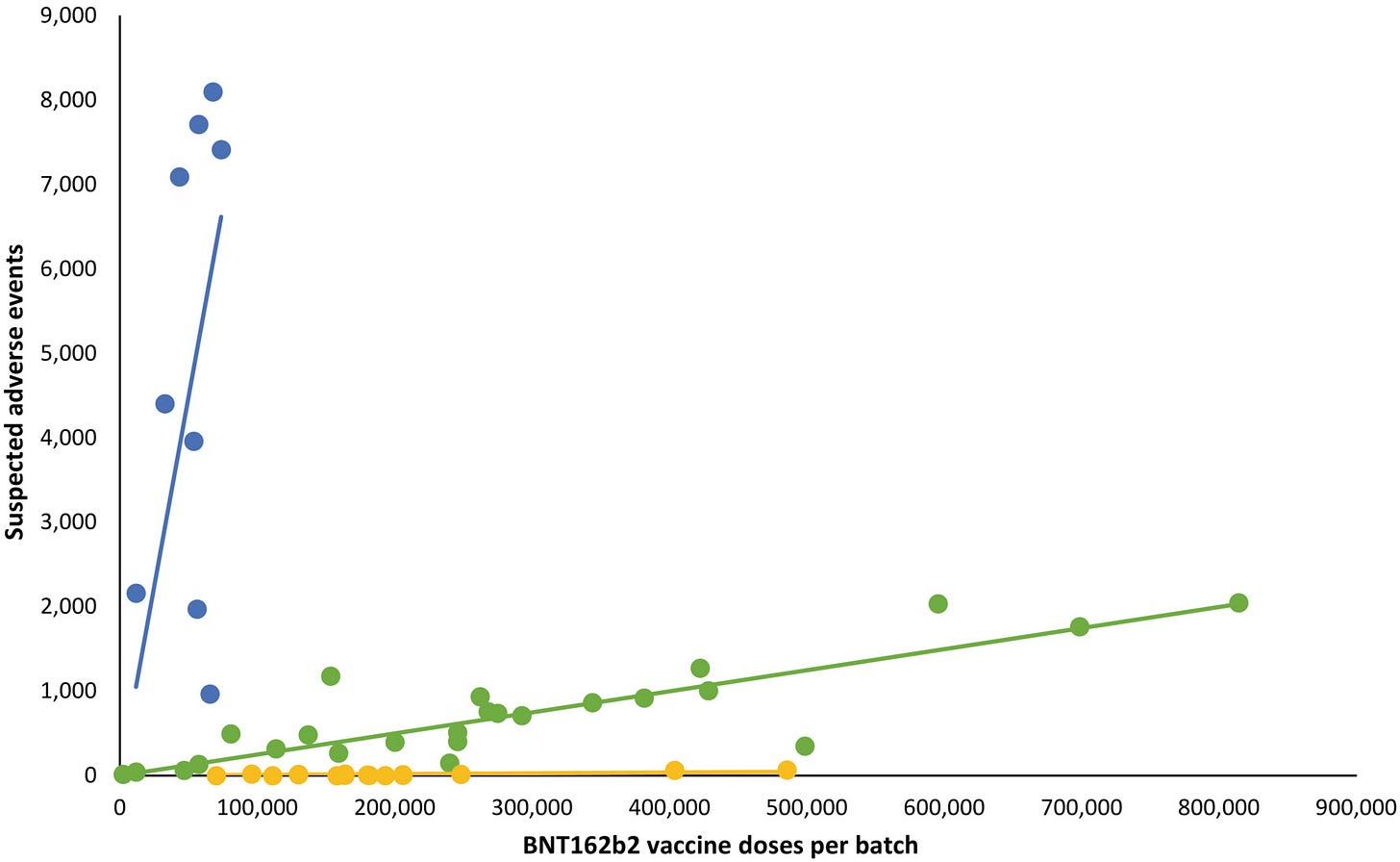
Celkovo bolo podaných 10,793,766 dávok 4,026,575 osobám s použitím 52 rôznych šarží vakcíny BNT162b2 (2,340–814,320 dávok na šaržu) a zaznamenaných bolo 43,496 SAE u 13,635 osôb, čo predstavuje 3,19 ± 0,03 (priemer ± SEM) SAE na osobu. [Oprava pridaná 09. júna 2023, po prvom uverejnení online: Celkový počet dávok a počty pacientov boli v predchádzajúcom vyhlásení opravené]. U každej osoby boli jednotlivé SAE spojené s dávkami vakcíny z 1,531 ± 0,004 šarží, čo viedlo k celkovému počtu 66,587 SAE rozdelených medzi 52 šarží. Označenia šarží boli neúplne zaznamenané alebo chýbali pri 7,11% SAE, takže na ďalšiu analýzu zostalo 61,847 SAE identifikovateľných podľa šarží, z ktorých 14,509 (23,5%) bolo klasifikovaných ako závažné SAE a 579 (0,9%) bolo úmrtí súvisiacich so SAE. Neočakávane sa počet SAE na 1,000 dávok medzi jednotlivými šaržami vakcíny značne líšil, pričom na 1,000 dávok pripadalo 2,32 (0,09–3,59) (medián [medzikvartilové rozpätie]) SAE a vo vzťahu medzi počtom SAE na 1,000 dávok a počtom dávok v jednotlivých šaržiach sa pozorovala významná heterogenita (p< ,0001). Rozpoznali sa tri prevládajúce trendové línie, pričom vo väčších šaržiach vakcíny boli badateľné nižšie počty SAE a ďalšia heterogenita v distribúcii závažnosti SAE v závislosti od šarže medzi jednotlivými šaržami, ktoré predstavujú tri trendové línie (obrázok 1). V porovnaní s počtom všetkých SAE boli závažné SAE a úmrtia súvisiace s SAE na 1,000 dávok oveľa menej časté a počty týchto SAE na 1,000 dávok vykazovali podstatne väčšiu variabilitu medzi jednotlivými šaržami s menším oddelením troch trendových línií (nezobrazené).
Pozorované rozdiely v počte a závažnosti SAE medzi jednotlivými šaržami vakcíny BTN162b2 v tejto celoštátnej štúdii boli v rozpore s očakávanou homogénnou mierou a rozdelením SAE medzi šaržami. V Dánsku a iných krajinách EÚ/EHP sa kvalita vakcín monitoruje podľa usmernení úradného kontrolného orgánu pre uvoľňovanie šarží (OCABR) a podľa našich vedomostí neboli predtým hlásené potenciálne rozdiely v klinickej bezpečnosti alebo účinnosti šarží vakcíny BNT162b2, napríklad v predregistračných štúdiách a následných populačných štúdiách (4,5). Takéto účinky sa môžu ľahšie zistiť v malých krajinách, ako je Dánsko, kde sa vakcíny BNT162b2 počas obdobia štúdie vo všeobecnosti poskytovali vo viacerých menších šaržiach. Aj regulačné monitorovanie a vedecký záujem o bezpečnosť vakcíny COVID-19 sa sústredili predovšetkým na závažné nežiaduce účinky, napríklad myokarditídu (6). V každom prípade si identifikácia takýchto účinkov zjavne vyžaduje, aby pozorované nežiaduce účinky boli spojené s príslušnými označeniami jednotlivých šarží a ich veľkosťou (počtom dávok). Predtým sa ukázalo, že odchýlky vo výrobe (kultivačnom raste) vakcíny Bacille Calmette-Guérin môžu ovplyvniť dôležité imunologické účinky tejto vakcíny (7) a boli hlásené dva prípady myokarditídy u dvoch mladých mužov po podaní mRNA-1273 vakcíny proti COVIDu-19 (Moderna) z tej istej šarže vakcíny v ten istý deň (8).
V skutočnosti sa môžu vyskytnúť odchýlky (od šarže k šarži, od liekovky k liekovke a dokonca od dávky k dávke) v očkovacích látkach v dôsledku variability a porušenia postupov, napríklad pri výrobe, skladovaní, preprave, klinickej manipulácii a aspektoch kontroly, a v roku 2021 boli v Japonsku stiahnuté tri šarže očkovacej látky mRNA-1273 v celkovom počte viac ako 1,6 milióna dávok potom, ako sa v 39 liekovkách tejto očkovacej látky zistilo, že obsahujú cudzie materiály (9). Uniknuté a sporné údaje tiež naznačujú, že niektoré skoré komerčné šarže vakcíny BNT162b2 obsahovali nižšie ako očakávané množstvo neporušenej mRNA (10).
OBRÁZOK 1: Počty podozrení na nežiaduce udalosti (SAE) po očkovaní mRNA vakcínou BNT612b2 v Dánsku (27. december 2020 až 11. január 2022) podľa počtu dávok v jednotlivých šaržiach vakcíny. Každá bodka predstavuje jednu dávku vakcíny. Trendové čiary sú lineárne regresné priamky. Modrá: R2 = 0,78, β = 0,0898 (95% interval spoľahlivosti [CI] 0,0514–0,1281), zelená: R2 = 0,89, β = 0,0025 (95% CI 0,0021–0,0029), žltá: R2 = 0,68, β = 0,000087 (95% CI 0,000056–0,000118). Šarže vakcín predstavujúce modrú, zelenú a žltú trendovú líniu tvorili 4,22%, 63,69% a 32,09% všetkých dávok vakcín, pričom 70,78%, 27,49% a 47,15% (modrá trendová línia), 28,84%, 71,50% a 51,99% (zelená trendová línia) a 0,38%, 1,01% a 0,86% (žltá trendová línia) všetkých SAE, závažných SAE a úmrtí súvisiacich so SAE.
Tieto predbežné zistenia sa musia interpretovať s ohľadom na niekoľko obmedzení. Systém spontánneho hlásenia SAE spravovaný DKMA v Dánsku je pasívny systém dohľadu podobný systému hlásenia nežiaducich udalostí vakcín (VAERS) v USA a hlásenia z týchto systémov podliehajú skresleniu hlásenia s možnosťou podhodnotenia aj nadhodnotenia, ako aj neúplnosti údajov a rôznej kvality hlásených informácií (11,12). Vzhľadom na tieto prirodzené obmedzenia sa signály zistené týmito systémami musia považovať za hypotézy a vo všeobecnosti sa nemôžu použiť na stanovenie kauzality (11–14). Okrem toho v tejto štúdii nebola známa história prípadov SAE predchádzajúcich COVIDu-19 a neboli skúmané špecifické typy SAE (orgánová trieda systému MedDRA atď.), demografické údaje o prípadoch SAE, vzťahy SAE s po sebe nasledujúcimi dávkami vakcíny v jednotlivých prípadoch, časové trendy v pozorovanej závislosti SAE od šarže, resp. vplyv šarže na účinnosť vakcíny. Je pozoruhodné, že podľa našich vedomostí Dánsky sérový inštitút nevydal žiadne rozhodnutie o stiahnutí šarží vakcíny BNT162b2. Záverom možno konštatovať, že výsledky naznačujú existenciu bezpečnostného signálu závislého od šarže vakcíny BNT162b2 a na preskúmanie tohto predbežného pozorovania a jeho dôsledkov sú potrebné ďalšie štúdie.